Gerçek Gaz Davranışına Teorik Yaklaşımlar
|
van der Walls Eşitliği İdeal gaz kanunları ve bu kanunlarından sapmalar hakkında fikir sahibi olduk. Hatta sapmaları açıklamak için deneysel bağıntılardan da söz ettik. Fakat neden gazların, ideal gaz kanunlarından saptıkları konusunda ayrıntılı teorik herhangi bir yaklaşımdan söz etmedik. Bu kısımda bu konu ele alınacaktır. 1873 yılında Hollandalı kimyacı J.D. van der Walls, gerçek gazların ideal gaz yasasından sapmalarını açıklamak için moleküler modele iki parametre ilave etti. Bu parametreler;
n mol gaz V hacimli bir yere konulduğunda moleküllerin bu hacim içinde serbestçe hareket ederken hacimlerini ihmal etmiştik. Fakat moleküllerin hacimleri kabın hacmi yanında ihmal edilemeyecek kadar fazla olabilir. Bu hacim dışarılanmış hacim (excluded volume) olarak adlandırılır. Bir mol gazın dışarılanmış hacmini b ile gösterirsek, PV=nRT eşitliğini \rm P(V-nb)=nRT \qquad \qquad \qquad (1)
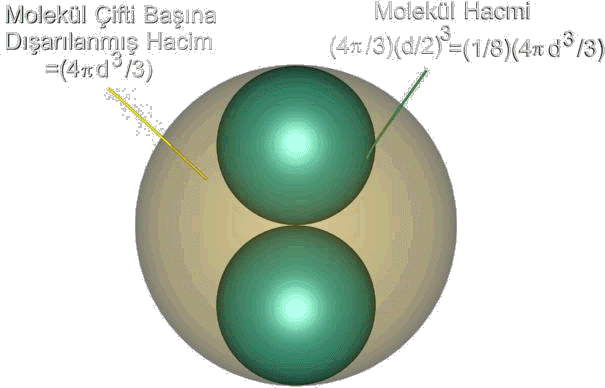
şeklinde düzenleyebiliriz. Dışarılanmış hacim, b, sabit bir değere sahiptir ve herhangi bir gaz için karakteristik olup deneysel verilerden hareketle elde edilebilir. b' nin molekül boyutuna bağımlılığını açıklamak için yandaki Şekil 1 den yararlanabiliriz. Eğer gaz moleküllerinin d çaplı bir küre olduklarını varsayarsak, iki molekülün merkezlerinin birbirlerine maksimum yaklaştıkları durumda gölgeli olarak çizilmiş bir d yarıçaplı küre içerisinde bulurlar. Molekül çifti başına dışarılanmış hacim \rm {4 \over 3}\pi d^3 olacaktır. Mol başına düşecek dışarılanmış hacim ise \rm b = 4N \Big[ { 4 \over 3} \pi \Big( {d \over 2 } \Big)^3 \Big] = { 2 \over 3 } \pi d^3 N \qquad \qquad \qquad (2)
eşitlikteki köşeli parantezler arasında kalan kısım molekül hacmi olup dışarılanmış hacim 4 kat daha fazladır. Düşük sıcaklıkta tüm gazların kinetik enerjilerinine karşın yoğunlaşma eğilimleri bu çekimin sonucudur. Bu sonucun tam olarak analizi zordur. Şekillerden de görüldüğü gibi gerçek gazlar çok düşük basınçlarda moleküller aralarında etkin çekim kuvvetleri oluşturmadıkları için dar basınç aralıklarında sıkıştırılabilmek föktörleri ideal gazların sahip olduğu Z = 1 değerinden daha düşük değerler alabilmektedir. Bu beklenen basıncın ideal gazlardan beklenen değerin altında kalması demektir. İdeal bir gazdan beklenene P değerine ulaşabilmek için, bu P değerine P' değerinin ilave yapılması gerekir. İlave edilmesi gereken bu P' değeri, gazın özelliğine ve gazın kapladığı hacmin karesiyle ters orantılı olarak değişir. Bu gazın konsantrasyonu ile orantılı olması anlamını taşır. Böylece P' =n2/V2 olarak yazılır. Son olarak van der Walls denklemi \rm (P + { n^2a \over V^2} )(V-nb)=nRT \qquad \qquad \qquad (3)
şekline ulaşır. Böylece PVT değerleri herbir gaz ve sıcaklık için kullanılabilecek hal eşitliği yazılmış olur. Bazı gazlar için a ve b değerleri Tablo 1 de verilmiştir.
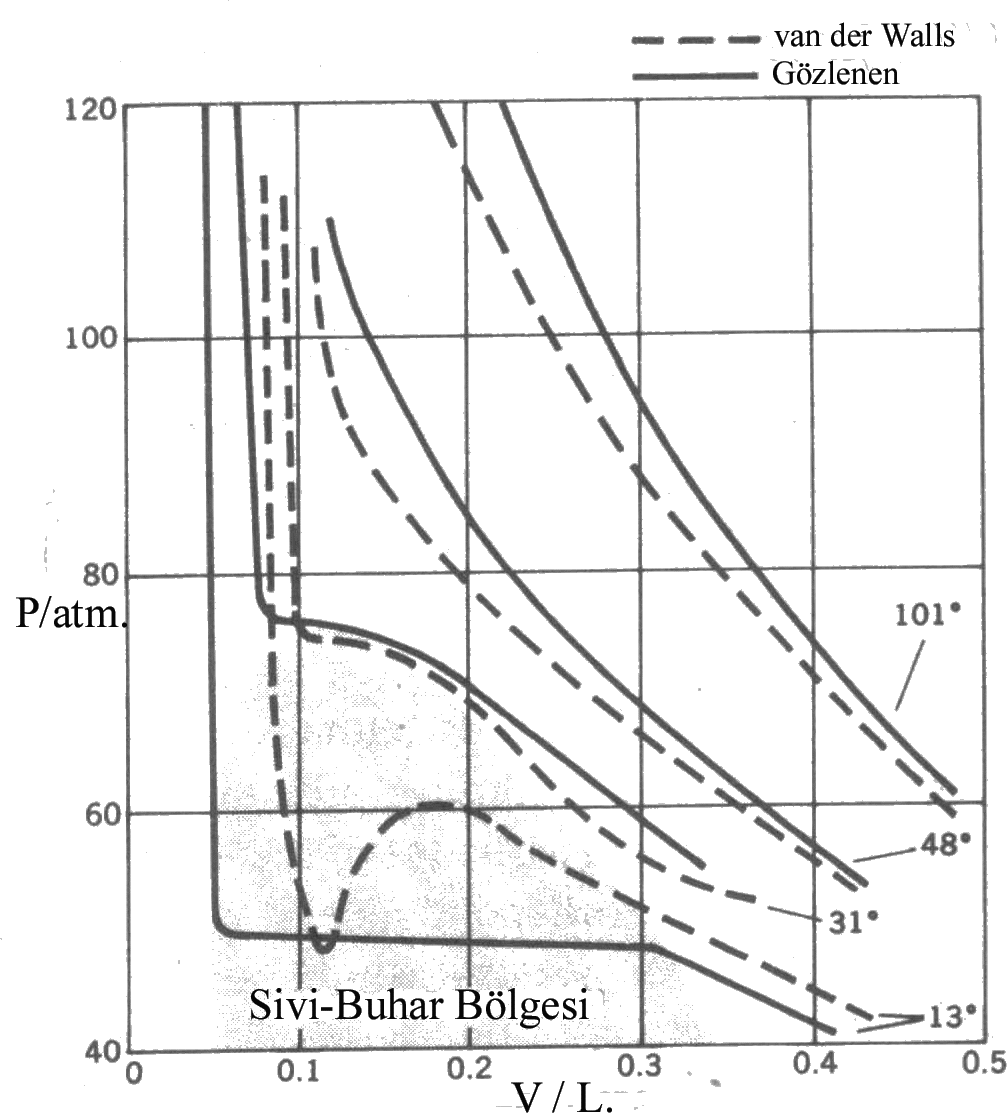
van der Walls Eşitliği ve Kritik Nokta Şekil 2 de sıvı-buhar dengesi bölgesine yakın noktalardaki gaz davranışları van der Walls eşitliği kullanılarak karşılaştırılmıştır. Şekilden de görüldüğü gibi denel değerlerle eşitlikten elde edilen değerlerin uyumu açıkça görülmektedir. 1 mol gaz için basınç;
\rm P = { RT \over V - b} - {a \over V^2} \qquad \qquad \qquad (4)
yazılabilir. dP/dV ve d2P/dV2 ye göre değişimi için; \rm { dP \over dV } = { RT \over (V - b)^2 } + {2a \over V^3} \qquad \qquad \qquad (5)
\rm { d^2P \over dV^2 } = { 2RT \over (V - b)^3 } + {6a \over V^4} \qquad \qquad \qquad (6)
yazılabilir. Birinci ve ikinci türev kritik noktada 0 dır ve mol başına hacim, basınç ve sıcaklık Vc, Pc ve Tc dir. Bu noktada; \rm P_c = { RT_c\over V_c - b } - { a \over V_c^2 } \qquad \qquad \qquad (7)
\rm 0 = -{ RT_c\over (V_c - b)^2 } + { 2a \over V_c^3 } \qquad \qquad \qquad (8)
\rm 0 = { 2RT_c \over (V_c - nb)^3 } - {6a \over V_c^4} \qquad \qquad \qquad (9)
yazılabilir. Bu üç eşitliklerden a, b ve R değerleri Pc, Vc, ve Tc değerlerine terimlerine bağlı olarak \rm b = {V_c \over 3} \qquad a = 3P_cVc^2 \qquad R={ 8P_cV_c\over 3T_c}
şeklinde elde edilebilir. Kritik değerler kullanılarak a, b değeri \rm a = { 27R^2T_c^2 \over 64P_c } \qquad \qquad \qquad (10)
\rm b = { RT_c \over 8P_c}\qquad \qquad \qquad (11)
eşitliklerinden hesaplanabilir. van der Walls Eşitliği ve Karşılıklı Haller İlkesi Deneysel veriler kullanılarak gazlar için karşılıklı haller ilkesine göre nasıl bir grafik ortaya çıkacağını daha önce göstermiştik (1). van der Walls eşitliğindeki a, b ve R değerleri kritik değerlere bağlı olarak yeniden yazılır ve Pr=P/Pc, Vr=V/Vc, Tr=T/Tc, değişimi gerçekleştirilirse \rm \Big( P_r + { 3 \over V_r^2} \Big) \Big( V_r - { 1 \over 3 }\Big) = {8 \over 3 } T_r
eşitliği elde edilebilir. van der Walls Eşitliği ve Virial Eşitlik 1 mol gaz için van der Walls eşitliğini \rm Z = { PV \over RT } = {V \over V - b} - {a \over RTV} = { 1 \over 1 - {b \over V} } - {a \over RTV}
şeklinde yazabiliriz. ( 1 - x )-1 in binomal açılımı; \rm (1-x)^{-1} = 1+x+x^2+...
şeklindedir. Yukarıdaki açılım ( 1 - b/V )-1 ile karşılaştırılırsa x < 1 değerleri için uygun sonuçlar elde edilir. Serinin ilk üç teriminini dikkate alarak ifadeyi yeniden düzenlersek \rm 1 + \Big( b - { a \over RT}{1 \over V} \Big) + {b^2 \over V^2} + ...
yazılabilir. İkinci terime kadar olan kısım dikkate alınacak olursa van der Walls eşitliği ile tam uyum içerisinde olduğu görülür. ( b - a/RT ) terimi sıcaklığa bağlıdır ve tablodaki BV(T) değerlerine benzer. Yüksek sıcaklıklarda b terimi baskın hale gelir ve ( b - a/RT ), b nin sabit değerine yaklaşır. Düşük sıcaklıklarda ise; a/RT değeri, b teriminden daha baskın olur ve( b - a/RT ) düşük sıcaklıklarda negatif işaretli olur. Böylece Boyle sıcaklığının van der Walls sabitleri ile \rm {a \over RT_{Boyle}} \quad \Rightarrow \quad T_{Boyle}={a \over bR} \qquad \qquad \qquad
şeklinde ilişkili olduğunu kolayca görebiliriz. Eğer a, b ve R nin değeri kritik değerlere bağlı olarak yerine konursa Boyle sıcaklığının \rm T_{Boyle}={27 T_c \over 8} \qquad \qquad \qquad
ifadesi ile ilişkili olduğu görülür. Gerçekte bu ilişki kabaca doğrudur Tablo 2 Boyle sıcaklıkları görülmektedir.
Dieterici Eşitliği Bu yaklaşıma göre; Gaz taneciklerinin hareketleri ortamdaki gaz konsantrasyonuna, n/V, bağlı olarak diğer gaz molekülleri tarafından büyük ölçüde engellenir. Bu durumda kabın çeperine ulaşabilecek taneciklerin E enerjisininde artması gerekir. Kinetik enerjileri ancak belli E değeri üzerinde olan tanecikler kabın çeperine ulaşabilecektir. Enerjileri E nin üzerinde bulunan taneceiklerin gaz taneciklerinin sayısı \rm e^{-{ E \over RT }} ile orantılıdır. Öte yandan, E enerjisinin büyüklüğü 1 mol gaz için molar hacim \rm \overline{V} ile ters orantılı olacaktır ( \rm E={ A \over \overline{V} }. Böylece yukarıdaki eşitlik \rm e^{-{ A \over RT\overline{V} }} şeklinde yeniden düzenlenebilir. Bu durumda ölçülen basınç P ise, Pi ideal basınç olmak üzere; \rm P_i = {P \over e^{-{ A \over RT \overline{V}}}}
eşitliği ile verilebilir. van der Walls denkleminde olduğu gibi \rm \overline{ V }_i= \overline{ V } - b değişimi gerçekleştirilirse Dieterici Hal Denklemi \rm {P \over e^{-{ A \over RT \overline{V}}}} \Big( \overline{ V } -b \Big) = RT \qquad \qquad \qquad (12)
şeklinde yazılabilir. n mol gaz için basıç \rm P = {nRT \over V-nb} e^{-{ nA \over RT \overline{V}}} \qquad \qquad \qquad (12)
şeklinde yazılabilir. van der Walls denkleminde olduğu gibi kritik sabitler belirlenebilir. 1 mol gaz için yukarıdaki türevleri işlemlerini uygulamadan önce Dieterici hal denkleminin logaritması alınırsa; \rm lnP = lnRT -ln( \overline{V} - b) - { A \over RT \overline{ V }}
yazılır ve sonra lnP nin hacime göre birinci ve ikinci türevleri 0 yapan şartlar araştırılırsa; \rm \Big( { \partial lnP \over \partial V} \Big)_T = - { 1 \over V_c - b} + { A \over RT_cV_c^2} = 0
\rm \Big( { \partial^{2} lnP \over \partial V^2 } \Big)_T = - { 1 \over (V_c - b)^2 } - { 2A \over RT_cV_c^3} = 0
eşitlikleri elde edilebilir. Bu eşitliklerden kritik büyüklükler \rm V_c = 2b \quad T_c={ A \over 4Rb}
şeklinde elde edilir. Bu değerler Hal denkleminde yerine konursa Pc için \rm P_c = { A e^{-2} \over 4b^2 }
değeri elde edilir. van der Walls ve Dieterici hal denklemleri arasında kritik değerler açısından kaynaklanan bu farkın nedeni yaklaşımdan kaynaklanmaktadır. Gerekli yaklaşımlar yapılırsa Dieterici denkleminden van der Walls denklemine ulaşılabilir. ex üstel fonksiyonu seriye açılırsa; \rm e^x = 1+ x + { x^2 \over 2! } + { x^3 \over 3! } + { x^4 \over 4! } + ... + { x^n \over n! }
ifadesi elde edilir. Dieterici hal denkleminde yer alan \rm e^{-{ A \over RT\overline{V} }} büyüklüğü seriye açılır ve ikinci terimden sonraki terimler ihmal edilecek olursa \rm e^{-{ A \over RT\overline{V} }} \simeq 1 + { 1 \over RT \overline{V} }
\rm e^{-{ A \over RT\overline{V} }} \simeq 1 + { 1 \over P \overline{V} }
bağıntısı elde edilir. Son ifade Dieterici denkleminde yerine konur ve A basınç düzeltme faktörü van der Walls denklemindeki a basınç düzeltme faktörüne eşit alınırsa van der Walls denklemi elde edilir. \rm P = {RT \over ( \overline{V} - b ) \Big( 1 + { A \over P \overline{V}^2 } \Big) }
\rm (P + { a \over V^2} )(V-b)=RT
|