Gazların Yoğunlaşması, Kritik Nokta ve Karşılıklı Haller İlkesi
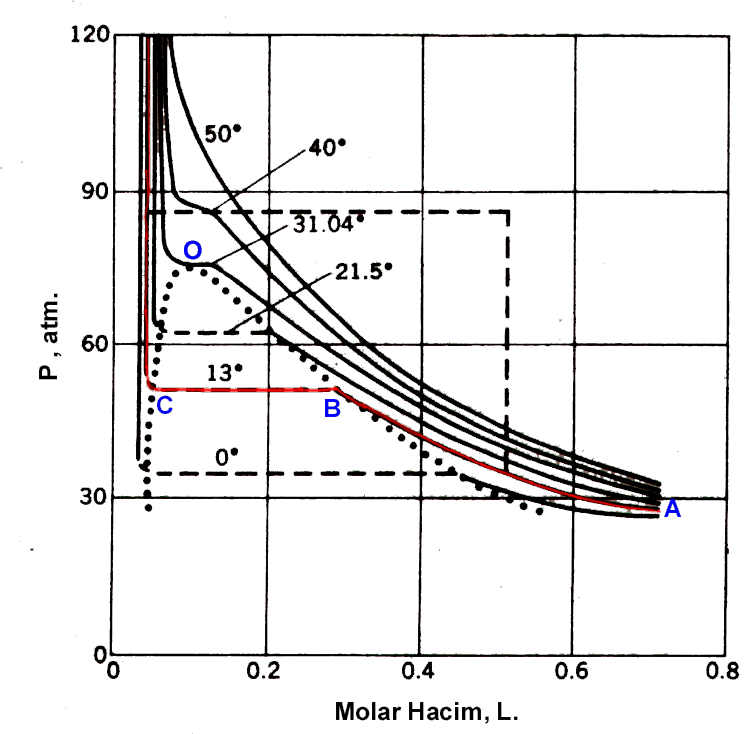
Şekil 1 de CO2 in yoğunlaşmasını belirlemek için elde edilmiş bir grup izotermi göstermektedir. Şekildeki veriler gazların davranışları üzerine 1869 da Andrews' in çalışmaları sonucu elde edilmiştir. Yüksek sıcaklıklardaki izotermler, ideal gazlar için beklenen hiperbolik eğrilerden biraz saparlarken, düşük sıcaklık izotermlerinde ise; ideal gaz yasasında önemli ölçüde sapma gösterirler. Düşük basınç değerlerinde ideal gaz davranışı görülür. Belli bir sıcaklıkta basınç arttıkça hacim Boyle Yasası'na uygun şekilde azalır.
Şekildeki noktalı çizgilerle gösterilmiş noktaya ulaşıldıktan sonra daha düşük sıcaklıklarda çalışılacak olursa, gazın basıncının arttırılmasıyla gaz sıkışmak yerine yoğunlaşır. Şekilde 21.5, 13 ve 0 oC de yoğunlaşmanın meydana geleceği basınçlar görülmektedir. Şekilden de görüldüğü gibi karbondioksit için kritik değer 31.04 oC dir. Bu sıcaklığın daha altında örneğin şekildeki gibi 13 oC de A noktasındayken basınç arttırılacak olursa B noktasına gelinceye kadar gazın basıncı artar. Bu noktadan sonra gaz sıkıştırılacak olursa basınç değişmeksizin gaz sıvılaşmaya başlar ve C noktasına ulaşılır. Noktalı eğri üzerinde sıvı-buhar birlikte dengededirler diğer bölgelerde yalnızca tek tip akışkan bulunur. Gaz sistemlerin ideal olmayan davranışlarına ilişkin çalışmalardaki ilginç bir yer grafikteki noktalı çizgidir. Bu kritik izoterm olarak adlandırılır. Kritik izotermin sıcaklığı kritik sıcaklıktır. Bu sıcaklık sıvı-buhar dengesinin bulunduğu en yüksek sıcaklıktır. O ile gösterilmiş olan nokta ise kritik noktadır. Bu noktadaki basınç, kritik basınç ve sıcaklık, kritik sıcaklık olarak isimlendirilir. Bazı maddeler ilişkin kritik değerler aşağıdaki Tablo 1 de gösterilmiştir. 1 atm. civarında kuru buz şeklindeki CO2 süblimleşir. Şekil 2 de yüksek basıncı bir kap içinde iken sıvı halde bulunan CO2 kritik sıcaklık civarında gaz ve sıvı arasındaki sınır çizgisi kaybolarak gaz dönüşümü görülmektedir.
Gerçek gazların ideallikten sapmaları gazın şartları ve kritik nokta arasındaki farka bağımlıdır. Bulunulan P,V, T değerlerini kritik değerlere bağlı olarak ifade edebiliriz. Bu değerler indirgenmiş değişkenler Pr, Vr ve Tr simgeleri ile \rm P_r = { P \over P_c } \; V_r = { V \over V_c } \; ve \; T_r = { T \over T_c }
eşitlikleri ile verilir. Eğer kritik değerler bilinirse gazın davranışı kolayca karakterize edilebilir. İndirgenmiş basıncın bir fonksiyonu olarak Z sıkıştırılabilirlik föktörü incelenebilir. Çeşitli indirgenmiş sıcaklıklarda farklı gazlar için yapılmış çalışmalar sonucu Şekil 2 dekine benzer grafikler elde edilir. Bu sonuçlar gazların ideallikten sapmalarının yalnızca indirgenmiş basınç ve sıcaklığa bağlı olduğunu gösterir. Bu ifade karşılıklı haller ilkesini olarak adlandırılır. İfadenin adı, aynı indirgenmiş değişkenlere sahip gazların aynı miktarda ideallikten sapmalarından hareketle verilmiştir.
Gerçek Gazlarla İlgili Bertholet Denklemi Yüksek basınçlarda Bertholet hal denklemiyle gerçek gazların deneysel sonuçları arasında paralellik sağlamak mümkün değildir. Denklem düşük basınçlarda daha uygun değerler vermektedir. Düşük basınçlarda 1 mol gaz için sıkıştırılabilirlik faktörü Z; \rm Z = 1 + {9 \over 128}{ P_r \over T_r} \Big( 1 - { 6 \over T_r^2} \Big)
eşitliği ile verilir. PV=ZnRT ifadesinden hareketle ifade \rm PV=nRT \Big[ {9 \over 128}{ P_r \over T_r} \Big( 1 - { 6 \over T_r^2} \Big) \Big]
şeklinde düzenlenebilir.
|