Gazların İdeal Olmayan Davranışları
|
Buraya kadar gazların PVT davranışları ile ilgili olarak Boyle, Charles Gay-Lussac yasalarına uyduğunu ve bu ilişkinin PV=nRT eşitliği ile genellenebileceğini ifade ettik. Bununla beraber, yüksek basınçlarda veya sıradan basınçlarda çok daha hassas ölçümler yapıldığında gazların bu yasalara uygun davranış göstermedikleri ortaya çıkartılmıştır. Bir gaz İdeal gaz kanunlarından saptığında, gazın davranışı için gerçek gaz veya ideal olmayan gaz terimleri kullanılır.
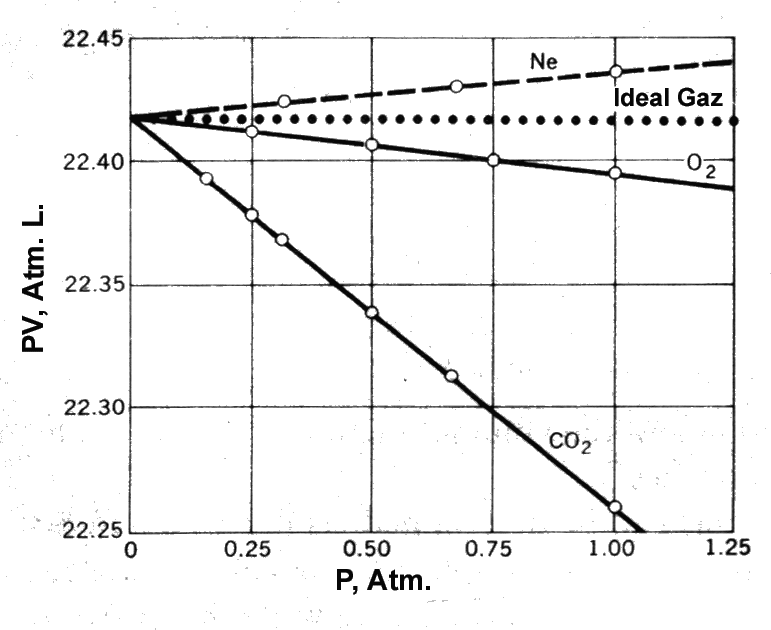
Düşük sayılabilecek basınçlarda birkaç gaz için 0 oC de 1 mol gaz için basıncın bir fonksiyonu olarak PV değerleri hassas belirlenerek Şekil 1 deki grafikte gösterilmiştir. İdeal davranış gösteren gazlar için PV değişimi basınçtan bağımsız olmalıdır. Grafiktende görüldüğü gibi Ne, O2 ve CO2 gazlarının hiçbiri için P ye karşı PV değişimi sabit değildir. Bu davranışı irdeleyecek olursak, bu bizi PV=nRT eşitliği üzerinde bazı değişiklikler yapmamız gerektiği gerçeğine götürür. 1 mol gaz bu davranışı tanımlamak için \rm PV = RT(1 - bP) \qquad \qquad \qquad (1)
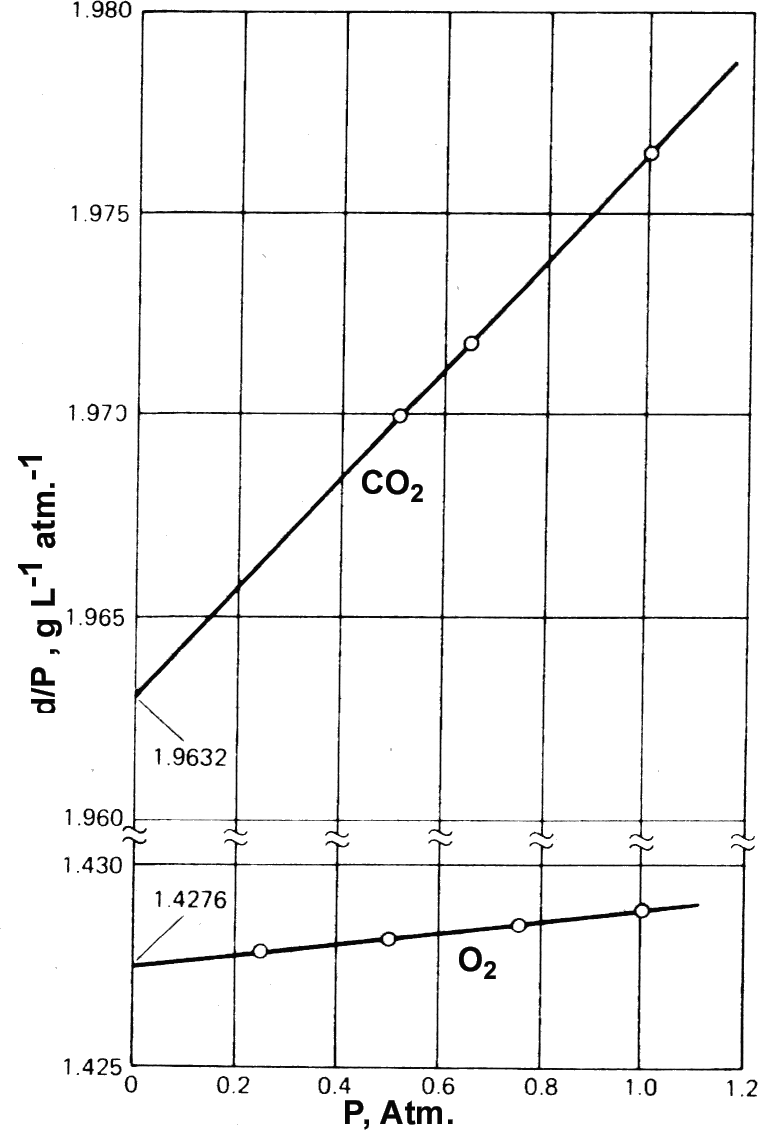
eşitliğini yazabiliriz. Buradaki b gazın doğasına özgü bir sabit olup sıcaklığın bir fonksiyonudur. Gazların yoğunluklarından hareketle gazın mol tartısı belirlenmek istenirse, gazın ideal gaz yasalarından sapıp sapmadığı hesaba katılmalıdır. İdeal davranış gösteren gazlar için gazın yoğunluğu basınç ile orantılıdır ve herhangi bir basınç için d/P oranı sabittir. Gerçek gazlar için ise Şekil 2 de görüldüğü gibi d/P basıncın fonksiyonudur. Buradaki değişim doğrusaldır ve
\rm {d \over P} = { M \over RT} (1 - b'P ) \qquad \qquad \qquad (2)
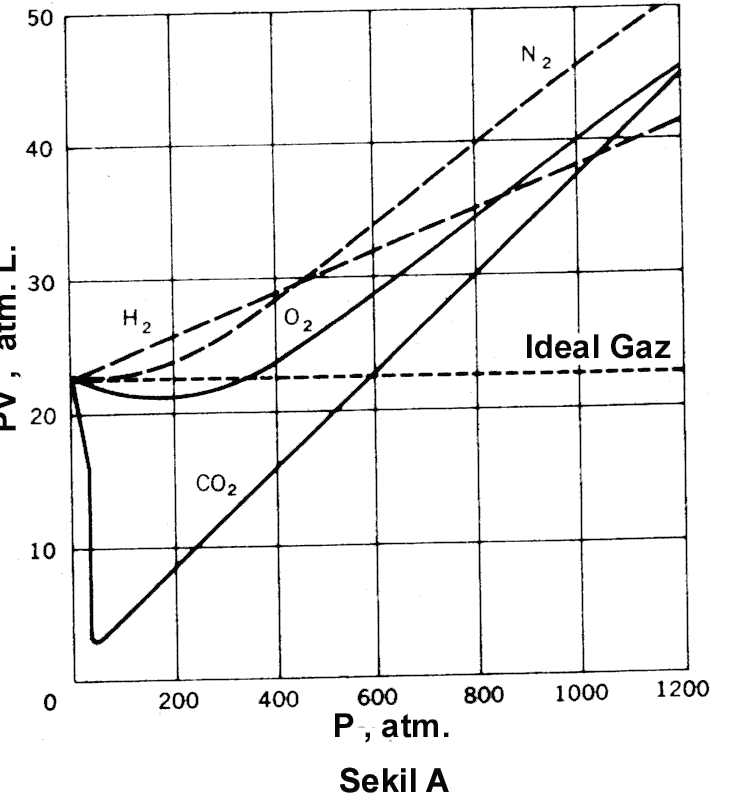
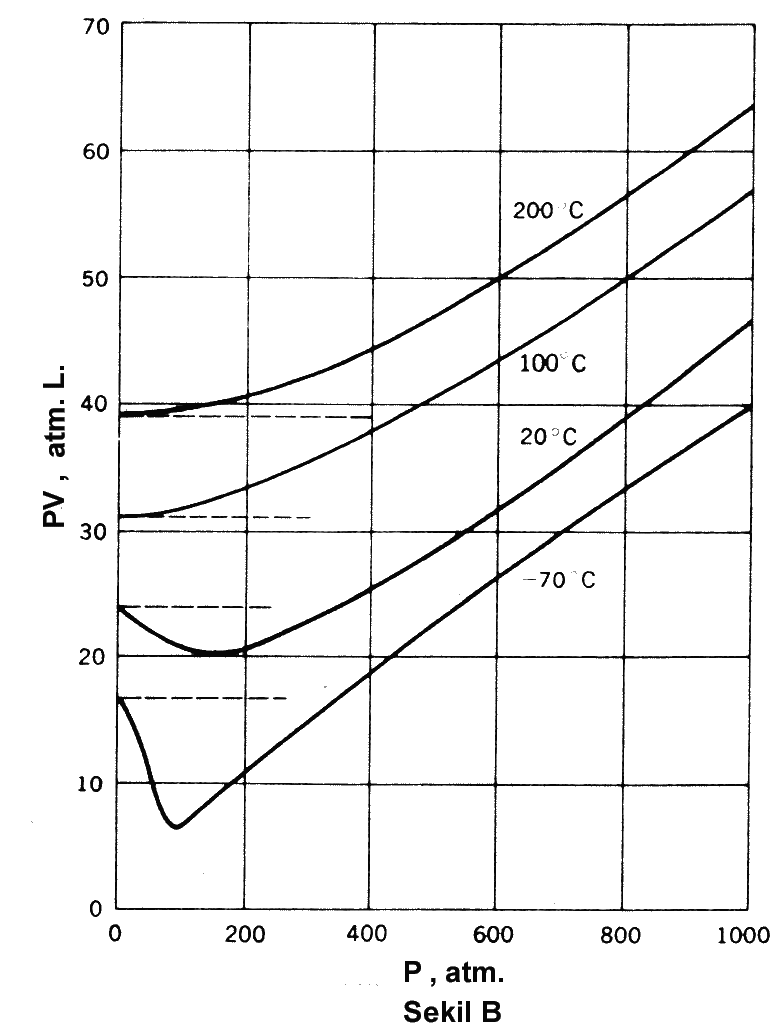
eşitliği ile verilir. Buradaki b' gazın doğası ve sıcaklığına bağlı sabit bir sayıdır. Gazın mol kütlesi basınç sıfıra giderken d/P oranından yararlanılarak hesaplanabilir. Gazların PVT davranışlarını veya maddenin diğer hallerini tanımlamak için yazılan eşitlikler Hal Eşitlikleri olarak adlandırılır. PV = nRT veya PV = RT ideal bir gaz için hal eşitliğidir. Eşitlik (1) de gerçek gazlar için kullanılan hal eşitliklerinden biridir. Benzer şekilde çeşitli eşitlikler kullanılır. Gerçek gazların farklı basınç-sıcaklık aralıklarındaki davranışlarını incelemek için farklı hal eşitliklerinin kullanılmasını gerekebilir. 0 oC de 1 mol gaz için, yüksek basınçlarda PV nin basınca bağımlılığı alttaki Şekil 3A da verilmiştir. Şekil 3B de ise, dört farklı sıcaklıkta metan için PV nin basınca bağımlılığı verilmiştir.
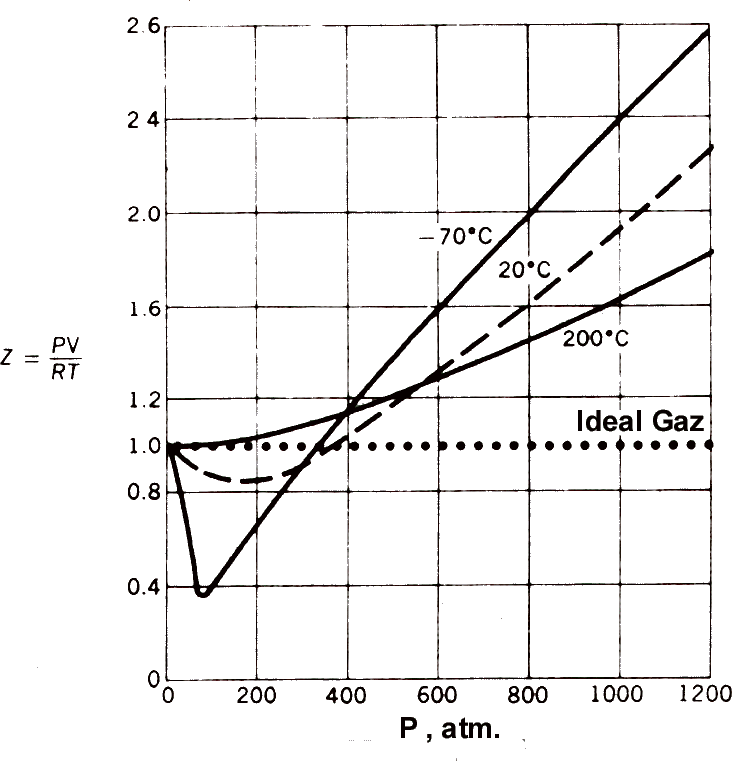
İdeallikten sapma, genellikle basınca karşı PV/RT değişiminden hareketle gösterilir. İdeal davranan gazlar için bu oran sabit ve 1 dir. PV/RT nin değeri genel olarak gazların idallikten sapmalarının bir ölçüsü olarak alınır ve bu oran sıkıştırılabilirlik föktörü, Z, olarak adlandırılır. İdeal davranış Z nin tüm sıcaklık ve basınçlarda değerinin 1 olmasını gerektirir.
Şekil 4 de metan için farklı sıcaklıklarda basınç ile sıkıştırılabilirlik föktörü Z'nin değişimi görülmektedir. Bu şekildeki gaz davranışlarını çözümleyebilmek için; \rm Z= {PV \over RT} = 1 + B_P(T)P + C_P(T)P^2 + ... \qquad \qquad \qquad (3)
şeklindeki virial eşitlik olarak adlandırılan eşitlikler kullanılır. BP(T) ve CP(T) katsayıları ise virial katsayılar olarak adlandırılır. Katsayılardaki P terimleri katsayıların basınca bağlı olduğunu gösterir. Parantezler içindeki T ler ise sıcaklığa bağımlılığı gösteririler. Başka bir viral katsayılar eşitliği; \rm Z= {PV \over RT} = 1 + {B_V(T) \over V} + { C_V(T) \over V^2 } + ... \qquad \qquad \qquad (4)
olup, BV(T) ve CV(T) katsayıları PVT değerlerinin ölçülmesiyle elde edilirler. Tablo 1 de metan için viral katsayılar verilmiştir. Hacime ve basınca bağlı virial katsayılar arasında BP=BV/RT şeklinde basit bir ilişki vardır. Şekil 4 den de görüldüğü gibi düşük sıcaklıklarda grafiğin eğimi negatif iken yüksek sıcaklıklarda pozitiftir. Eşitlik 3 ve 4 deki B katsayılarının değeri bu eğime eşittir. Şekillerdeki izotermlerden de görüldüğü gibi basınç sıfıra giderken \rm { d(PV)\over dP} değeri de sıfıra ulaşır ve PV değeri sabit bir değere sahiptir. B = 0 şartını sağlayan sıcaklık Boyle Sıcaklığı olarak adlandırılır.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||