|
Birleşik Gaz Yasası
İdeal gazlara ilişkin P=f(V), ve V=f(T) ilişkisinin nasıl olduğunu inceledik.
Çoğu kez P, V, T aynı anda değişime uğrayabilir.
Bu durumda yeni duruma karşı gelen büyüklüklerin ne olduğunu söyleyebilmek için yeni bir eşitliğe ihtiyaç duyabiliriz.
Bu iki yasayı birlikte inceleyen ve ilgili değişkenleri bir ifade de bulunduran yasaya da Birleşik Gaz Yasası
adı verilir.
Birleşik gaz yasasına ilişkin denklemi türetebilmek için aşağıdaki Şekil 1 i düşünelim.
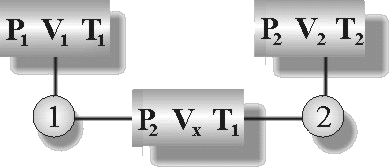
Şekil 1 : P,V,T nin birlikte değiştiği bir sistemde. |
Burada P1, V1 ve T1 durumundaki sistemin, 1 ve 2 yolundan ilerleyerek P2, V2 ve T2 durumuna ulaştığını varsayalım.
1. adımda sıcaklık (T1) sabit olup hacim - basınç değişimi meydana gelmiştir
(Boyle Yasası).
2. adımda ise basınç (P2) sabit olup hacim sıcaklık değişimi meydana gelmiştir
(Charles Yasası).
1. nolu basamağa göre;
\rm {V_x \over V_1} = { P_1 \over P_2 }
2. nolu basamağa göre
\rm {V_2 \over V_x} = { T_2 \over T_1 }
yazılır. Her iki eşitlikteki Vx büyüklükleri birbirine eşitlenirse;
\rm {P_1V_1 \over P_2} = V_x = { T_1V_2 \over T_2 } \; veya \; {P_1V_1 \over T_1} = {P_2V_2 \over T_2} = k_3
yazılabilir.
Soru 1 :
Sabit bileşimdeki bir gaz örneği 1 atm. ve 15 oC de deniz seviyesinde 1.00 L. hacim kaplamaktadır.
Basıncın 1.6x10-11 atm. ve sıcaklığın 1580 K olduğu 500 km. yukarıdaki hacmi ne kadardır?
Yanıt 1 :
Pi= 1 atm., Vi= 1.00 L, Ti= 273.16+ 15 K dir.
Ps= 1.6x10-11 atm., Ts= 1580 K değerine değişmiştir.
Bileşik gaz yasasına göre sonuç kolayca bulunabilir.
\rm V_s = { P_i V_i \over T_i} { T_s \over P_s}
\rm V_s = { (1.0 \; atm.)(1.0 \; L.) \over 288.16 \; K } { 1580 \; K \over 1.6 \times 10^{-11} \; atm.} = 3.43 \times 10^{11} \; L
olarak elde edilir.
Bir gazın hacmi gazın mol sayısı ile doğru orantılıdır \rm (V \; \alpha \; n).
Böylece;
\rm {PV \over T} = k_3 = nR
yazılabilir. Buradaki R; genel gaz sabitidir. Gaz sabiti;
\rm R = {PV \over nT}
olarak yazılabilir.
Soru 2 :
İdeal davranış gösteren bir gazın 1.0 molü 273.16 K ve 1.0 atm. basınçta 22.413 L. hacim kapladığına göre genel gaz sabitinin değerini hesaplayınız.
Yanıt 2 :
\rm R = {PV \over nT}
\rm R = {(1.0 \; atm.)(22.413 \; L) \over (1.0 \; mol)(273.16 \; K)} = 0.082 \; atm. \; L. \; mol^{-1} \; K^{-1}
olarak genel gaz sabitinin değeri elde edilebilir.
Genel gaz sabitinin daha hassas olarak belirlenmiş değeri 0.082057366080960 atm. L. mol-1 K-1 olarak hesaplanmıştır.
Bir gazın mol tartısını genel gaz denkleminden hareketle hesaplayabiliriz. Gaz örneğinin mol saysı, n, için; n=m/M ve gazın yoğunluğu, d, için; d=m/V yazılırsa, mol tartısı içinBir gazın mol tartısını genel gaz denkleminden hareketle hesaplayabiliriz. Gaz örneğinin mol saysı, n, için; n=m/M ve gazın yoğunluğu, d, için; d=m/V yazılırsa, mol tartısı için
\rm M = {d \over P}RT
eşitliği elde edilebilir.
Gerçek gazlar için yüksek basınçlarda gazın ideallikten saptığını daha önce belirtmiştik.
Bu nedenle; bir gazın mol tartısı doğru olarak hesaplanmak istenirse P \rightarrow 0 değerine giderken ortaya çıkan d/P değerinin büyüklüğünden yararlanarak mol tartısının hesaplanması daha az hatalı sonuçların elde edilmesi için önemlidir
(1).
\rm M = \Big( {d \over P} \Big)_{P \rightarrow 0} RT
Genel Gaz Sabiti ve Birimleri
Gaz sabiti, R, yalnızca PVT hesaplamalarını kapsamaz. Moleküler sistemlerin enerjileri üzerinde yapılan hesaplamalarda da kullanılır.
\rm R = {PV \over nT}
\rm R = {\Big( {Kuvvet \over Yüzey }\Big)(Yüzey \times Uzunluk ) \over (mol)(K)} = { Kuvvet \times Uzunluk \over mol \times Kelvin} = { İş \over mol \times K }
Uzunluk ile kuvvetin çarpımı ise enerjiye karşı gelir. Bu nedenle R nin boyutu, mol kelvin başına enerji büyüklüğünü gösterir. Şimdi R nin sayısal değerini enerjiye bağlı olarak nasıl hesaplayacağımızı gösterelim. Bu amaçla CGS veya MKS birim sistemlerinden birini kullanabiliriz.
1.0 atmosfer basınç; 1.0 cm2 kesitinde 76.0 cm yüksekliğindeki civa kolonunun tabanda oluşturacağı basınç büyüklüğüdür.
0 oC de civanın yoğunluğu 13.595 g cm-3 ve yerçekim ivmesi 980.66 cm s-2 olarak alınacak olursa,
gaz sabiti
\rm R = {PV \over nT} = { {\Big( {(76.0 \; cm)(13.595 \; g \; cm^3 )(1.0 \; cm^2)(980.66 \; cm \; s^{-2}) \over 1 \; cm^3 } \Big) }(22413 cm^3) \over (1.0 \; mol)(273.16 \; K)} = 8.314 \times 10^7 \; erg \; mol^{-1} \; K^{-1}
olarak hesaplanabilir.
1 Joule = 107 erg ve 1 calori = 4.18 Joule olduğundan,
R nin değeri 8.314 J mol-1 K-1 veya 1.987 cal mol-1 K-1 olarak elde edilebilir.
Gaz sabitinin daha hassas hesaplanmış değerleri
8.31446261815324×107 erg mol-1 K-1
8.31446261815324 J mol-1 K-1 veya 1.98720425864083 cal mol-1 K-1
dir.
Herhangi bir ideal davranış gösteren gazın mol sayısı, sıcaklığı, basınç ve hacmine bağlı olarak kullanılabilecek
bir denklem
\rm PV = nRT
şeklinde yazılabilir. Bu denklem İdeal Gaz Denklemi veya Genel Gaz Denklemiolarak adlandırılır.
|
