|
Charles-Gay Lussac Kanunu Boyle Kanunun bulunuşunun üstünden yüzyıl geçmiş olmasına karşın, gazın hacmi ile sıcaklığı arasındaki ilişki araştırılamamıştı. Bunun nedeni basınç ile sıcaklık arasında karşılaştırma yapamamaktı. Soğuk ve sıcak kavramları olmasına karşın henüz bu aralıkta ısı derecesi konusunda herhangi bir şey söylenememişti. Ancak 18 yüzyılın sonlarına doğru bir cam tüp içindeki sıvının genleşmesinden yararlanılarak sıcaklık derecesini ölçmek için ilk modern termometrenin yapılması başarılabildi. Suyun normal donma noktasına 0 ve normal kaynama noktasına 100 değeri verilerek 100 eşit parçaya bölündü. Termometrenin bulunmasıyla birlikte sıcaklıkla gaz hacimlerinin değişimini araştırmak mümkün oldu.
Fransız bilim adamı Jacques Charles 1787'nin başlarında ve daha sonra Fransız bilim adamı J. L. Gay-Lussac 1808 de Sabit basınçta gaz örneği hacminin sıcaklıkla nasıl değişiğini gösterdi. Yapılan deneylerde gazın hacminin sıcaklığın 1 oC değişmesiyle yaklaşık olarak 1/273 de kadar değişime uğradığı görülmüştür. Eğer gazın 0 oC deki hacmi Vo, ve t sıcaklığındaki hacmini Vt ile gösterirsek; \rm V_t = V_o + V_o \alpha t
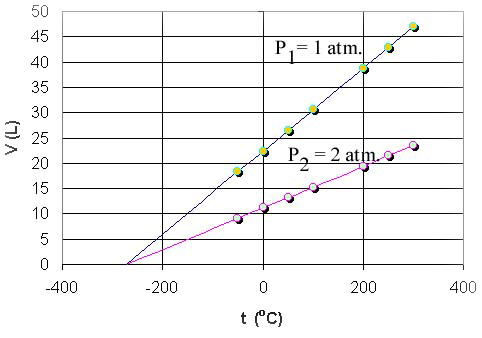
eşitliği yazılabilir. Buradaki \rm \alpha gazın termal genleşme katsayısıdır ve biraz önce yukarıda söz ettğimiz gibi ideal gazlar için değeri yaklaşık olarak 1/273 kadardır. Şekil 2 de görüldüğü gibi gaz hacminin sıfıra yaklaştığı uç sıcaklık değerinin büyüklüğünü belirlemeye çalışırsak t için;
\rm V_t = V_o + V_o {1 \over 273} t
\rm 0 = V_o \Big( 1 + {1 \over 273} t \Big)
\rm t = -273 ^oC
değeri elde edilir.
Bununla beraber; gaz hacminin sıfır olması demek
maddenin bulunmaması anlamına geleceğinden mantıklı değildir.
Daha düşük sıcaklıklara gidildikçe gazlar gerçek gaz davranışı göstermeye başlayarak bu yasadan saparlar.
Yine de bu uç değer bugün daha dikkatli hesaplanmış ve -273.16 oC olarak bulunmuştur. Bu değer mutlak sıfırdır.
Kelvin sıkalasında 0 K değerine karşı gelir. Herhangi bir celsius sıcaklığı kelvin skalasına dönüştürmek için
T = t İki farklı sıcaklık ve hacim ilişkileri için \rm { V_t \over V_o} = { T_t \over T_o}
eşitliği yazılabilir. Bu eşitlikleri kullanarak daha belli miktarda gazın sabit basınçta hacim-sıcaklık ilişkisi için \rm V=k_2T
ifadesi verilebilir. Bu ifade Charles Gay-Lussac yasası olarak bilinir.
İdeal davranış gösteren 30 oC deki bir gaz örneğinin 5 oC lik sıcaklık artışı ile hacminin 12 cm3 artığı gözlenmiştir. Gaz örneğinin 30 oC deki hacmi ne kadardır? |
|||||