Üç Bileşenli Sistemlerde Sabit Basınç ve Sıcaklıktaki Faz Diyagramları
Gibbs Fazlar Kuralı eşitliği
\rm F = 2 + C-P
olduğundan homojen 3 bileşenli bir sistem için
\rm F = 2 + C-P
\rm F = 2 + (3)-P = 5-P
yazılabilir. Sıcaklık ve basınç değişkenleri sabitse,
\rm F = 3-P
yazılabilir. İki fazlı bir üç bileşenli sistem için F=1 olacaktır.
Bunun anlamı bir bileşenin miktarının değiştirilmesi veya bilinmesi ile
diğer iki fazın miktarı veya bileşimi bilinebilir demektir.
Eğer faz sayısı 3 ise F=0 olur. Bu faz diyagramında tek bir noktaya karşı gelir.
Bu tür sistemlerin sabit basınç ve sıcaklıktaki faz diyagramlarını çizmek için
üçgensel koordinat sistemi kullanılır. Bu tür sistemlere örnek olarak Şekil 1 deki faz diyagram örneği verilebilir.
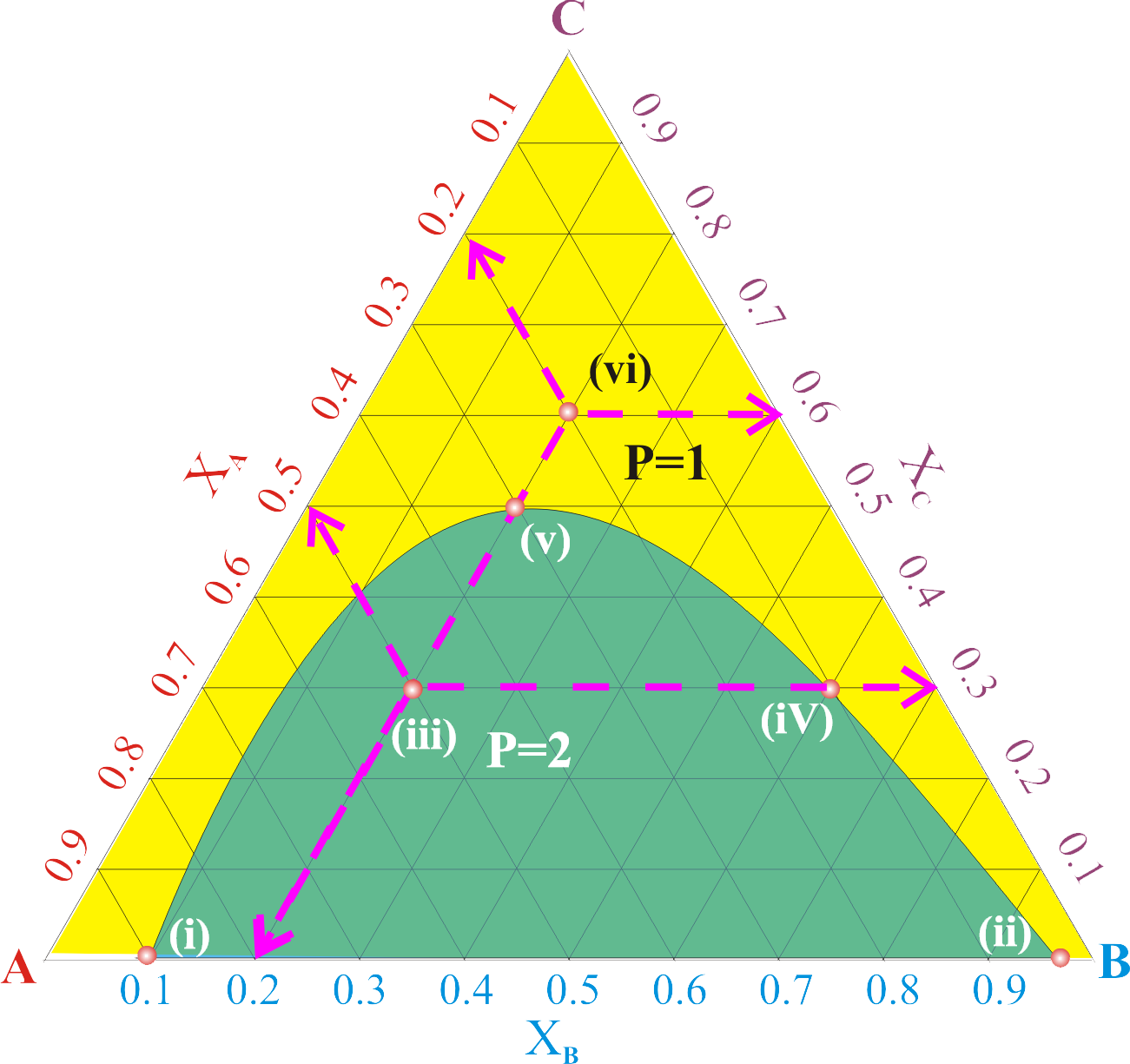
Şekil 1 : Sabit sıcaklık ve basınçta, A, B ve C bileşenlerinden oluşan Üç bileşenli bir sistemin faz diyagramı.
|
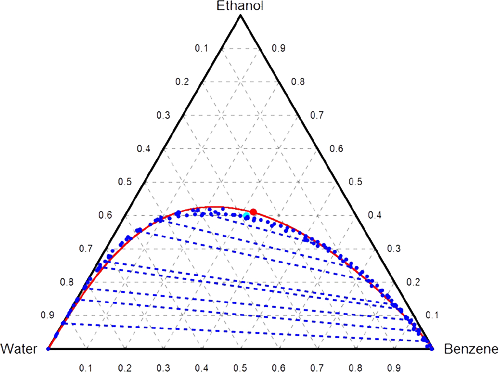
Şekil 2 : 1 bar ve 25 \rm ^oC de, su, benzen ve metanolün faz diyagramı.
|
Şekil 1 de yer alan grafik üzerindeki alanlar ve noktalar :
-
Sarı renkli olarak görülen alanda A,B ve C maddeleri tek bir faz oluşturmaktadır (P=1).
Yeşil renkli olarak görülen alanda ise A,B ve C maddeleri iki faz oluşturmaktadır (P=2).
-
(i) noktasında (A,B,C) mol kesirleri (0.9,0.1,0.0) dır. A ve B doğrusu saf A içine B eklenerek elde edilmiştir.
Saf A içine çok az B eklendiğinde A içinde B çözünmüştür. Bu nedenle sistem tek fazlıdır.
Ancak B nin mol kesri 0.1 olduğunda kritik bir eşiğe ulaşılmıştır. \rm \chi _B > 0.1 olduğunda sistem 2 fazlı olmuştur. Bu durumda A fazı B ye doymuştur.
Ayrılan B fazıda A ya doymuştur. A içine B eklenmeye devam edilirse (ii) noktasına ulaşılır. Daha fazla B eklenirse
sistemdeki A fazı tamamen B fazında çözünerek sistem yeniden tek fazlı hale gelecektir ( yaklaşık \rm \chi _B > 0.95 )
-
(iii) noktasında sistem iki fazlıdır. Bu noktada (A,B,C) mol kesirleri (0.5, 0.2, 0.3) tür.
(iv) noktası ise kritik bir noktadır. Bu noktada (A,B,C) mol kesirleri (0.1, 0.6, 0.3) tür.
-
(v) noktası A, B ve C türlerinin birbiri içinde maksimum şekilde çözünerek tek faz oluşturabildikleri bir nokta olup
bu noktada (A,B,C) mol kesirleri (0.3, 0.2, 0.5) tir.
-
(vi) noktasında sistem tek fazlıdır ve bu noktada (A,B,C) mol kesirleri (0.2, 0.2, 0.6) dır.
Şekil 2 de ise, Şekil 1 dekine benzer 1.0 bar ve 25 \rm ^oC de elde edilmiş su, benzen ve metanol sisteminin
faz diyagramı görülmektedir.
Şekil 2 den de kolayca görüleceği gibi su-metanol ve benzen-metanol her oranda birbiri içinde çözünebilmektedir.
Ancak su benzende veya benzende su hemen hemen hiç çözünmemektedir.
Bu 3 tür tek faz oluşturarak birbiri içinde maksimum çözünebildikleri oran (Su, Benzen, Metanol) yaklaşık olarak
(0.37, 0.2, 0.43) civarında olduğu grafikten görülmektedir.
|

