Tek Bileşenli Sistemler Faz Dengelerine Termodinamik Yaklaşım
Serbest enerji denge konumu ile doğrudan ilişkili olan termodinamik bir özelliktir.
Faz diyagramlarında basınç ve sıcaklığa bağlı olarak faz dengelerinin nasıl değişeceğini görmüştük.
Bu kısımda kalitatif olarak bu ilişkileri daha ayrıntılı açıklamaya çalışacağız.
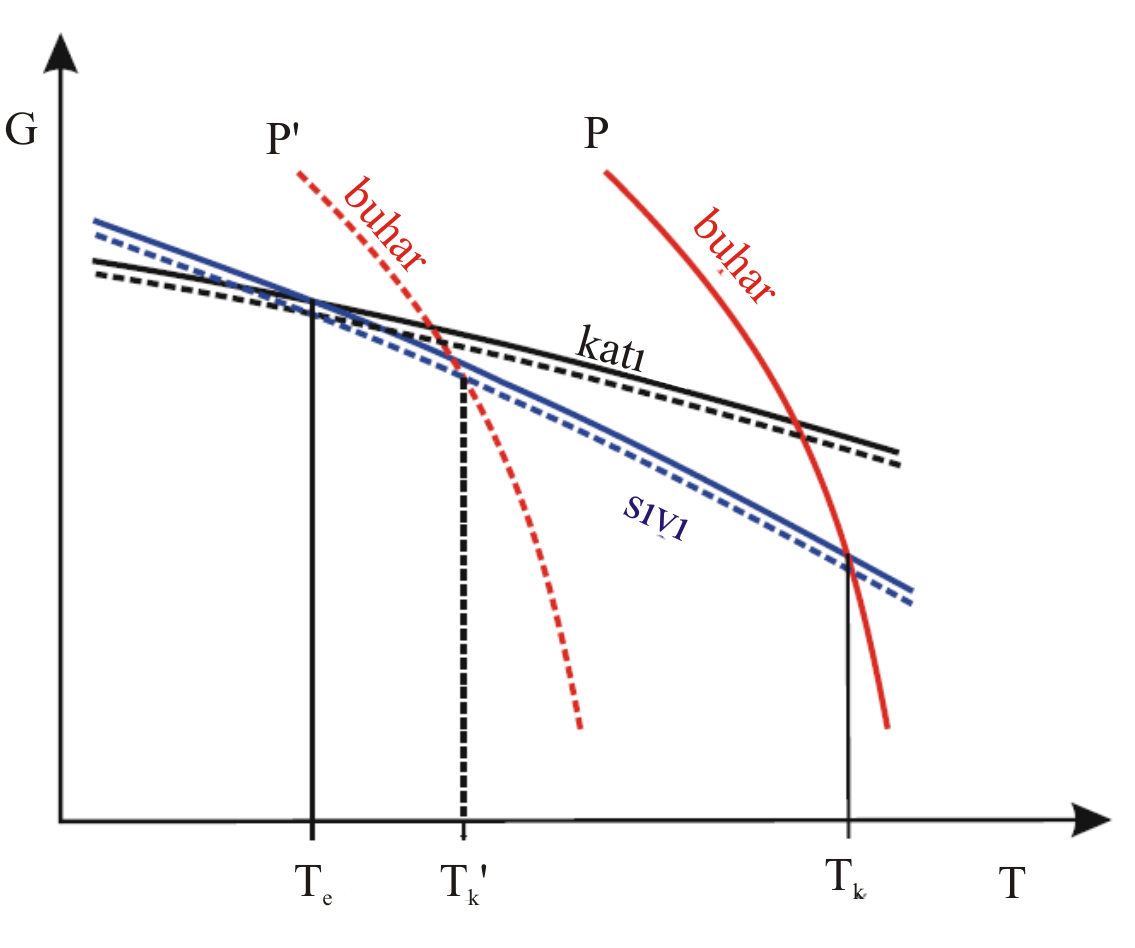
Şekil 1 : Sıcaklığın fonksiyonu olarak saf bir maddenin farklı fazlarının Gibbs Serbest Enerji değişimi.
Katı fazın düşük basınçta (P', kesikli çizgi ) ve yüksek basınçtaki (P, düz çizgi) sıcaklıkla Gibbs serbest enerji değişimini,
Sıvı fazın düşük basınçta (P', kesikli çizgi ) ve yüksek basınçtaki (P, düz çizgi) sıcaklıkla Gibbs serbest enerji değişimini,
Gaz fazın düşük basınçta (P', kesikli çizgi ) ve yüksek basınçtaki (P, düz çizgi) sıcaklıkla Gibbs serbest enerji değişimini
göstermektedir.
Saf maddenin kaynama noktasındaki değişimler \rm T_b (yüksek basınçta),
\rm T_b ^' (düşük basınçtaki) değerlerini göstermektedir.
Saf maddenin erime noktasındaki değişimler \rm T_e (yüksek basınçta),
\rm T_e ^' hemen hemen üst üste binişmiştir.
Bu nedenle yalnızca \rm T_e işaretlenmiştir.
|
Sıcaklık ve basıncın Gibbs serbest enerjisi üzerine
\rm \Big( { \partial G \over \partial P } \Big)_T=V \qquad \qquad (Eşitlik I)
\rm \Big( { \partial G \over \partial T } \Big)_P=-S \qquad \qquad (Eşitlik II)
ilişkilerini daha önce bulmuştuk.
\rm \Big( { \partial G \over \partial T } \Big)_P =-S eşitliğine göre T ye karşı G nin değişimi
grafik edildiğinde grafiğin ilgili sıcaklıktaki eğimi, o noktada faz değişimi için entropi değişimini vermelidir.
\rm S_{g} \gg S_{s} > S_{k}
olduğu net olarak görülmektedir.
Şekil 1 G(T,P) fonksiyonunun iki farklı basınçtaki kesitlerini göstermektedir.
G(T) nin basınç ile değişimi fazların molar hacimlerine bağlıdır (Eşitlik I).
Buharın molar hacmi (kritik noktadan uzakta) katı ve sıvınınkinden çok daha büyük olduğundan,
Şekil 1 den de görüldüğü gibi buharın G(T) eğrisi, katı ve sıvının G(T) eğrisine göre çok daha fazla kayar.
Daha düşük basınç değerlerinde sıvının G(T) değeri katıdan ve buharın G(T) değerinden daha büyük olduğunda
katı erimeden doğrudan buharlaşır. Buna süblimleşme adı verilir.
Katı, sıvı ve buharın serbest enerjilerinin eşit olduğu sıcaklıkta, bu üç faz aynı anda dengede bulunabilecektir. Bu nokta üçlü nokta olarak adlandırılır.
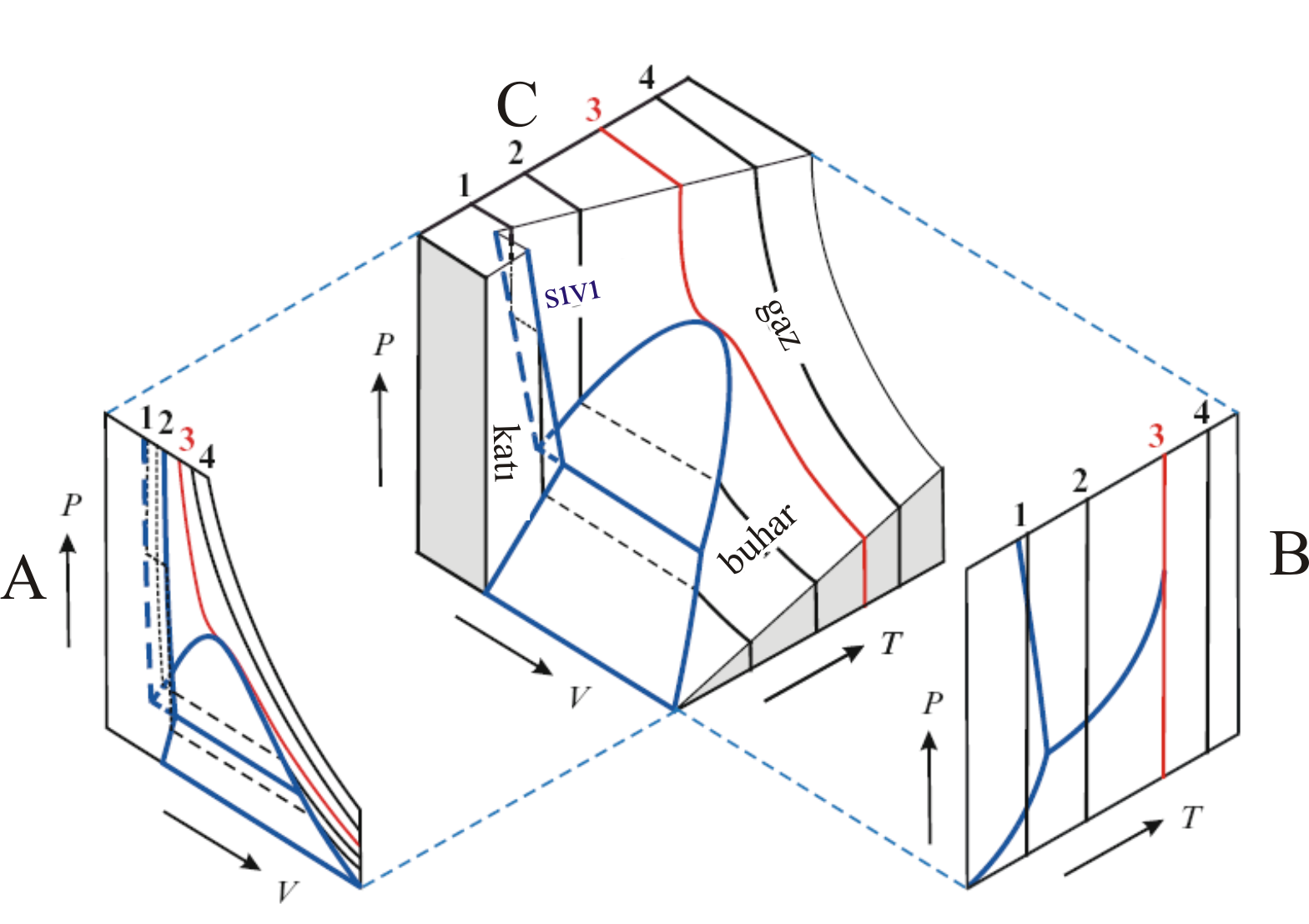
Şekil 2 :
Saf bir maddenin P-V-T diyagramı ve bu diyagramın 2 boyutlu projeksiyonları.
|
Bazı maddelerin faz diyagramlarında sıvı faz ile denge halindeki katı fazların sıvı fazdan daha büyük bir molar hacme sahip olduğu durum söz konusudur.
Bu tür maddelerde donma anında molar hacimleri daralmak yerine artar.
Şekil 2 de B perpektifi bu tür davranış gösteren maddelerin faz diyagramları için örnek olarak verilebilir.
Bu maddeler için en iyi bildiğimiz örnek sudur. Bu nedenle su donduğunda içinde bulunduğu şişeyi kırabilir veya boruları patlatabilir.
|