Çözücülerde Donma Noktası Düşmesi
Uçucu madde içermeyen çözücülerde özellikle seyreltik çözeltilerde birim hacimdeki çözünen moleküllerin sayısına bağlı
olarak donma noktasında düşme meydana gelir. Bu olay çözücünün doğasına bağlı ve çözünen türün doğasından bağımsız ve yalnızca
mol kesrine yani tanecik sayısına bağlı olarak değişir. Tanecik sayısına bağlı olarak değişen özellliklere
koligatif özellik adı verilir. Bu nedenle;
çözücünün "donma noktası düşmesi kolligatif bir özelliktir." denir.
Kolligatif özellikler ortamdaki tanecik sayısı ile ilişkili olduğundan çözünen türün elektrolit olması durumunda;
elektrolitin iyonlaşması nedeni ile ortamdaki tanecik sayısı değişeceğinden beklenen değerden farklı sonuçlar elde edilebilir.
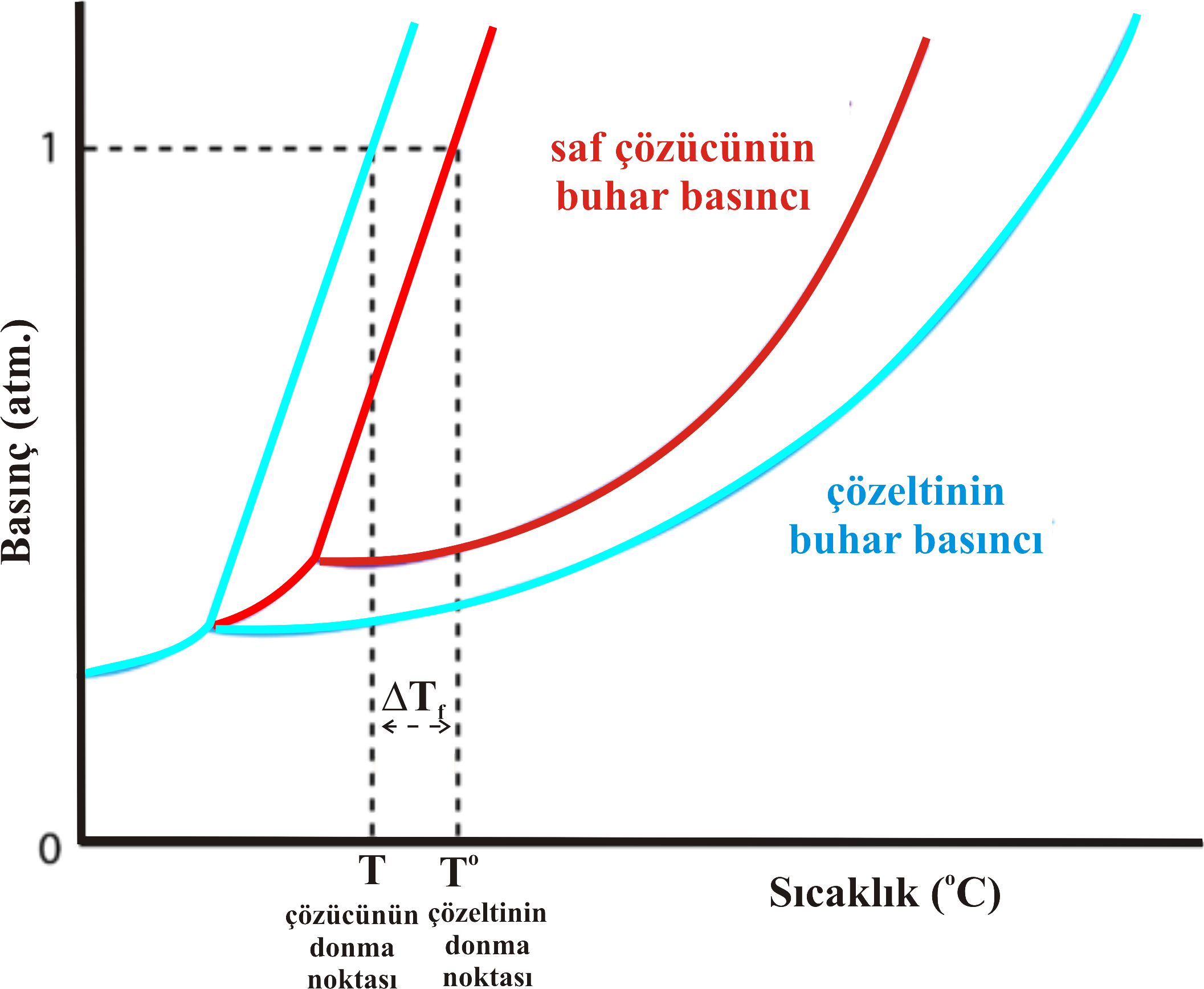
Şekil 1 : Çözeltinin donma noktası saf çözücüye göre daha düşüktür.
|
Şekil 1 den görüldüğü gibi çözeltinin donma noktası saf çözücüye göre daha düşüktür.
Sıcaklıktaki düşme miktarı \rm \Delta T_f=T^o - T olup seyreltik çözeltilerde çözünenin konsantrasyonu ile ilişkilidir.
Daha önce çözeltilerin kaynama noktasındaki yükselmesi ile ilgili olarak \rm T^o ; saf çözücünün kaynama noktası ve
\rm \Delta H^b ; saf çözücünün buharlaşma entalpisi olmak üzere
\rm \Delta T_b = K_b m \qquad \qquad \qquad K_b = { R{T^o}^2 \over \Delta H_b n_1} \qquad \qquad
eşitliğini türetmiştik.
Donma noktası alçalması ile ilgili olarak da benzer yaklaşımlar ile;
\rm T^o ; saf çözücünün donma noktası ve
\rm \Delta H^e ; saf çözücünün erime entalpisi olmak üzere
\rm \Delta T_f = K_f m \qquad \qquad \qquad K_f = { R{T^o}^2 \over \Delta H_f n_1} \qquad \qquad
eşitliği elde edilebilir.
Su buharlaşma entalpisi 6.01 kJ \rm mol^{-1} olduğuna göre normal erime noktası
0 \rm ^oC için \rm K_f değerini hesaplayarak Tablo 1 deki \rm K_f değeri ile karşılaştırınız.
\rm K_f = { R{T^o}^2 \over \Delta H_b n_1}
\rm K_f = { (8.314 \; J \; mol^{-1} \; K^{-1})(273 \; K)^2 \over
( 6010 \; J \; mol^{-1} ) ( 1000 \; g / 18 \; g \; mol^{-1} )} =
1.856 K \; mol^{-1} \; (1000 \; g \; çözgen)^{-1}
Tablo 1 : Bazı maddelerin donma noktası düşmesi \rm K_f değerleri.
| Çözücü |
Normal
Donma
Noktası |
\rm K_f |
| \rm CH_3COOH |
16.7 |
3.90 |
| \rm C_6H_6 |
5.5 |
5.12 |
| \rm HCBr_3 |
7.8 |
14.40 |
| \rm C_6H_{12} |
6.5 |
20.0 |
| \rm 1,4-dioksan |
10.5 |
4.90 |
| \rm C_6H_5OH |
42 |
7.27 |
| \rm H_2O |
0.0 |
1.86 |
|