Çözücülerde Buhar Basıncı Düşmesi
Uçucu madde içermeyen çözücülerde özellikle seyreltik çözeltilerde birim hacimdeki çözünen moleküllerin sayısına bağlı
olarak kaynama noktasında yükselme meydana gelir.
Bu olay çözücünün doğasına bağlı ve çözünen türün doğasından bağımsız ve yalnızca
mol kesrine yani tanecik sayısına bağlı olarak değişir. Tanecik sayısına bağlı olarak değişen özellliklere
koligatif özellik adı verilir. Bu nedenle;
çözücünün "kaynama noktası düşmesi kolligatif bir özelliktir." denir.
Kolligatif özellikler ortamdaki tanecik sayısı ile ilişkili olduğundan çözünen türün elektrolit olması durumunda;
elektrolitin iyonlaşması nedeni ile ortamdaki tanecik sayısı değişeceğinden beklenen değerden farklı sonuçlar elde edilebilir.
Çözünen maddenin elektrolit olmaması durumunda, çözücünün buhar basıncındaki düşmeden çözünen türün mol tartısı veya bazı termodinamik büyüklükleri bulunabilir.
Çözücü içinde uçucu olmayan bir maddenin çözünmesi sonucu, çözücünün buhar basıncındaki değişim Raoult Kanununa uyar.
Çözücünün saf haldeki buhar basıncı \rm P^o iken, çözücünün mol kesri; \rm \chi _1 ise buhar basıncı için
\rm P=P^o \chi _1 \qquad \qquad ( Eşitlik \; 1 )
yazılabilir. Buhar basıncındaki düşme ise;
\rm \Delta P = P^o - P = P^o - P^o \chi _1 \qquad \qquad ( Eşitlik \; 2 )
Çözünenin mol kesri \rm \chi _2 ise;
\rm \Delta P = P^o - P = P^o - P^o ( 1- \chi _2)
\rm \Delta P = P^o \chi _2 \qquad \qquad ( Eşitlik \; 3 )
yazılabilir. Çözünen türün mol kesri için
\rm \chi_2 = { \Delta P \over P^o } \qquad \qquad ( Eşitlik \; 4 )
eşitliği elde edilebilir.
500 g suya 50 g sakkaroz eklendiğinde normal kaynama noktasındaki buhar basıncının ne kadar düşeceğini hesaplayız.
suyun ve sakkarozun mol sayısı;
\rm n_{su} = {m_{su} \over M_{su}} \qquad \Rightarrow \qquad n_{su} = {500 \; g \over 18 \; g \; mol^{-1} } = 27.78 \; mol
\rm n_{sakkaroz} = {m_{sakkaroz} \over M_{sakkaroz}} \qquad \Rightarrow \qquad n_{sakkaroz} = {50 \; g \over 342 \; g \; mol^{-1} } = 0.15 \; mol
Sakkarozun mol kesri;
\rm \chi_{sakkaroz} = { n_{sakkaroz} \over n_{sakkaroz} + n_{su}} \qquad \Rightarrow \qquad \chi_{sakkaroz} ={ 0.15 \; mol \over 0.15 \; mol + 27.78 \; mol } = 0.0054
Buhar basıncı düşmesi;
\rm \Delta P_{su} = P^o \chi _2 \qquad \Rightarrow \qquad \Delta P_{su} = (760 \; mmHg)(5.4 \times 10^{-3}) = 4.104 \; mmHg
Eşitlik 4 den
\rm { n_2 \over n_2+n_1 } = { \Delta P \over P^o } \qquad \qquad
\rm { m_2/M_2 \over m_2/M_2 + m_1/M_1 } = { \Delta P \over P^o } \qquad \qquad
Seyreltik bir çözelti durumunda \rm m_2/M_2 \ll m_1/M_1 olduğundan \rm m_2/M_2 , \rm m_1/M_1 yanında ihmal edilebilir.
Böylece
\rm { \Delta P \over P^o }= { m_2 M_1 \over m_1M_2 } \qquad \qquad (Eşitlik \; 5)
elde edilebilir.
.
Çözücülerde Kaynama Noktası Yükselmesi
Çözününün buhar basıncının saf çözücüye göre daha düşük olması nedeni ile
saf çözücünün kaynadığı basınca ulaşması için saf çözücüye göre sıcaklığının daha yüksek olması gerekecektir.
Bu durum Şekil 1 deki çizim üzerinde gösterilmiştir.
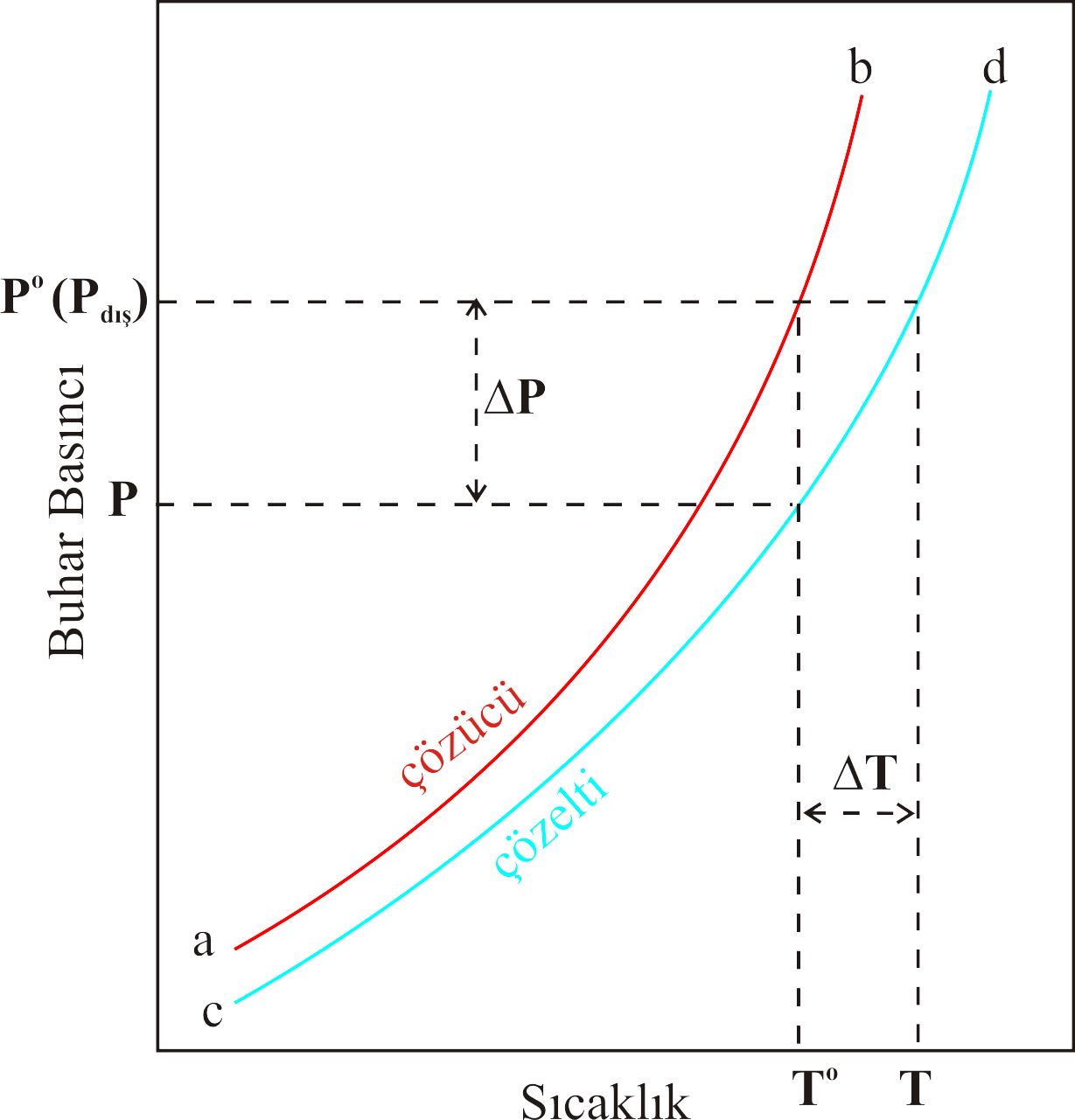
Şekil 1 : Çözeltinin kaynama noktası saf çözücüye göre daha yüksektir.
|
Şekil 1 de saf çözücünün sıcaklık ile buhar basıncının değişimi ab eğrisi ile, çözeltisinin buhar basıncının sıcaklık ile değişimi cd
eğrisi ile gösterilmiştir.
Şekil 1 den görüldüğü gibi \rm T^o sıcaklığında \rm P^o basıncına ulaşan çözücünün buhar basıncı dış basınç
\rm P_{dış} olduğundan kaynamaya başlar. Ancak çözücün içerisine uçucu olmayan bir madde katıldığında
Eşitlik 3 e göre buhar basıncı \rm \Delta P kadar azalır ve P basıncına düşer. Çözeltinin yeniden kayması için
buhar basıncının dış basınca eşit olabilmesi için \rm \Delta T kadar daha sıcaklığının arttırılarak T değerine ulaşması ile
çözelti kaynamaya başlar. Ancak T sıcaklığı, \rm T^o sıcaklığından daha yüksek olduğundan çözeltinin kaynama noktası yükselmiş olur.
Kaynama noktalarındaki ve bu kaynama noktalarındaki buhar basıncı değişimleri
Clasius-Clapayron denklemi ve Raoult Kanunu ile birlikte düşünülürse ve birleştirilirlerse
\rm ln { P \over P^o} = - { \Delta H_b \over R } \Big( {1 \over T } - {1 \over T^o } \Big) \qquad \qquad (Eşitlik \; 6)
\rm ln { P \over P^o} = - { \Delta H_b \over R } \Big( {T^o - T \over T T^o } \Big) \qquad \qquad
\rm - ln { P \over P^o} = { \Delta H_b \over R } \Big( { T -T^o \over T T^o } \Big) \qquad \qquad (Eşitlik \; 7)
Eşitlik 7 ' deki \rm \Delta T_b = T-T^o ve T yaklaşık olarak \rm T^o olarak alınabileceğinden;
\rm - ln { P \over P^o} = { \Delta H_b \over R } { \Delta T_b \over { T^o } ^2 } \qquad \qquad (Eşitlik \; 8)
Ayrıca
\rm {P \over P^o} = \chi _1 = (1- \chi _2)
olduğundan;
\rm ln (1- \chi _2) = - { \Delta H_b \over R } { \Delta T_b \over { T^o } ^2 } \qquad \qquad
eşitliğin sol tarafı yeriye açılırsa
\rm ln (1- \chi _2) = - \chi _2 + { \chi _2 ^2 \over 2 } + { \chi _2 ^3 \over 3 } + ...
Çok seyreltik çözelti durumunda \rm \chi _2 çok küçük olacağından yalnızca ilk terim dışındaki terimler dikkate alınmayabilir. Böylece;
\rm \Delta T_b = { R{T^o}^2 \over \Delta H_b}. \chi _2 \qquad \qquad (Eşitlik \; 9)
\rm \chi _2, 1000 g çözücüde çözünen maddenin küçük bir kısmı için kaynama noktasındaki yükselme için
\rm \Delta T_b = { R{T^o}^2 \over \Delta H_b}. \Big( { m \over n_1 + m } \Big) \simeq { R{T^o}^2 \over \Delta H_b}. \Big( { m \over n_1 } \Big) \qquad \qquad
\rm \Delta T_b \simeq { R{T^o}^2 \over \Delta H_b n_1} m \qquad \qquad (Eşitlik \; 10)
yazılabilir. Burada m; çözünen maddenin molalitesini göstermektedir.
Eşitlik 10 dan görüldüğü gibi çözücünün kaynama noktasındaki yükselme \rm \Delta T_b;
Çözücünün buharlaşma entalpisi, \rm \Delta H_b,
saf çözücünün kaynama noktası, \rm T^o ,
gaz sabiti, R,
1000 g çözücünün mol sayısı \rm n_1
sabit olduğundan
\rm \Delta T_b = K_b m \qquad \qquad \qquad K_b = { R{T^o}^2 \over \Delta H_b n_1} \qquad \qquad \qquad (Eşitlik \; 11)
Eşitlik 11 den görüldüğü gibi kaynama noktasındaki yükselme çözücüye özgün
bir sabit olan \rm K_b sabitine ve çözünen maddenin molalitesine bağımlıdır.
Başka bir deyişle kaynama noktasındaki yükselme çözünen maddenin tanecik sayısına bağımlı olduğundan kolligatif bir özelliktir.
Tablo 1 de çeşitli maddeler için \rm K_b değerleri verilmiştir.
Su buharlaşma entalpisi 40.656 kJ \rm mol^{-1} olduğuna göre normal noktası 100 \rm ^oC için \rm K_b değerini hesaplayarak Tablo 1 deki \rm K_b değeri ile karşılaştırınız.
\rm K_b = { R{T^o}^2 \over \Delta H_b n_1}
\rm K_b = { (8.314 \; J \; mol^{-1} \; K^{-1})(373 \; K)^2 \over ( 40656 \; J \; mol^{-1} ) ( 1000 \; g / 18 \; g \; mol^{-1} )} = 0.512 K \; mol^{-1} \; (1000 \; g \; çözgen)^{-1}
Tablo 1 : Bazı maddelerin kaynama noktası yükselme sabiti \rm K_b değerleri.
| Çözücü |
Normal
Kaynama
Noktası |
\rm K_b |
| \rm (CH_{3})_{2}CO |
56.5 |
1.72 |
| \rm CCl_4 |
76.8 |
5.00 |
| \rm C_6H_6 |
80.1 |
2.57 |
| \rm HCCl_3 |
61.2 |
3.88 |
| \rm C_2H_5OH |
78.4 |
1.20 |
| \rm (C_2H_5)_2O |
34.6 |
2.11 |
| \rm CH_3OH |
64.7 |
0.80 |
| \rm H_2O |
100.0 |
0.52 |
|