Gazların İdeal Olmayan Davranışları
Buraya kadar gazların PVT davranışları ile ilgili olarak Boyle, Charles
Gay-Lussac yasalarına uyduğunu ve bu ilişkinin PV= nRT eşitliği ile
genellenebileceğini ifade ettik. Bununla beraber, yüksek basınçlarda veya sıradan
basınçlarda çok daha hassas ölçümler yapıldığında gazların bu yasalara uygun
davranış göstermedikleri ortaya çıkartılmıştır. Bir gaz İdeal gaz kanunlarından
saptığında, gazın davranışı için gerçek gaz veya ideal olmayan gaz
terimleri kullanılır.
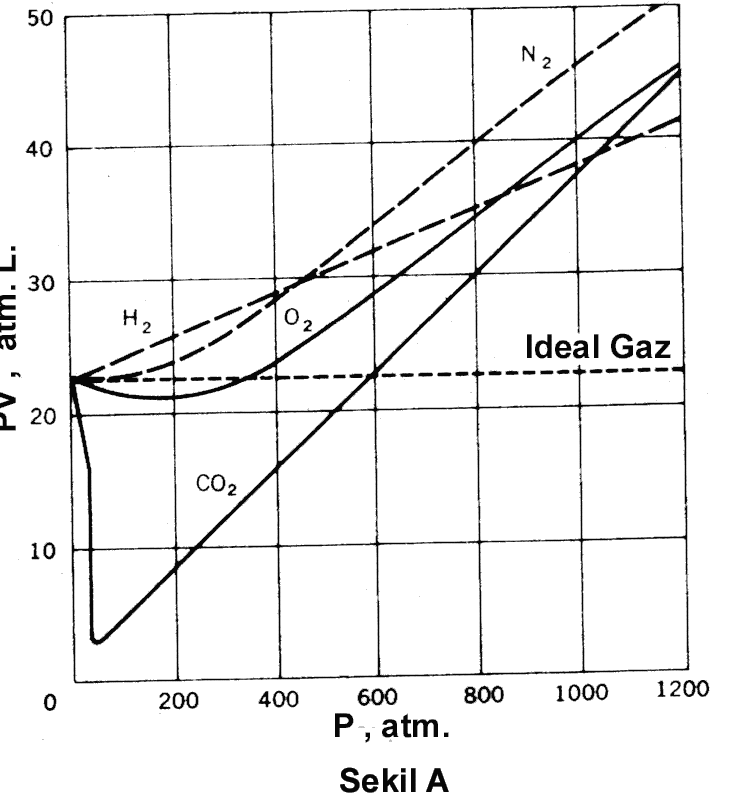
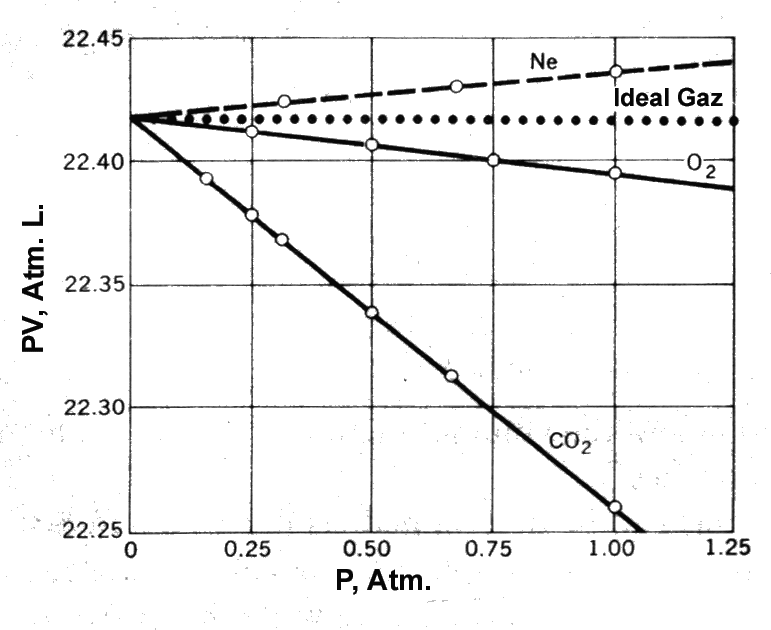 Düşük sayılabilecek basınçlarda
birkaç gaz için 0 oC de 1 mol gaz için basıncın bir fonksiyonu olarak PV
değerleri hassas belirlenerek yandaki grafikte verilmiştir. İdeal davranış
gösteren gazlar için PV değişimi basınçtan bağımsız olmalıdır. Grafiktende
görüldüğü gibi Ne, O2 ve CO2 gazlarının hiçbiri için
P ye karşı PV değişimi sabit değildir. Bu davranışı irdeleyecek olursak, bu
bizi PV=nRT eşitliği üzerinde bazı değişiklikler yapmamız gerektiği
gerçeğine götürür. 1 mol gaz bu davranışı tanımlamak için
Düşük sayılabilecek basınçlarda
birkaç gaz için 0 oC de 1 mol gaz için basıncın bir fonksiyonu olarak PV
değerleri hassas belirlenerek yandaki grafikte verilmiştir. İdeal davranış
gösteren gazlar için PV değişimi basınçtan bağımsız olmalıdır. Grafiktende
görüldüğü gibi Ne, O2 ve CO2 gazlarının hiçbiri için
P ye karşı PV değişimi sabit değildir. Bu davranışı irdeleyecek olursak, bu
bizi PV=nRT eşitliği üzerinde bazı değişiklikler yapmamız gerektiği
gerçeğine götürür. 1 mol gaz bu davranışı tanımlamak için
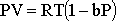
eşitliğini yazabiliriz. Buradaki b gazın
doğasına özgü bir sabit olup sıcaklığın bir fonksiyonudur. Gazların
yoğunluklarından hareketle gazın mol tartısı belirlenmek istenirse, gazın
ideal gaz yasalarından sapıp sapmadığı hesaba katılmalıdır. İdeal davranış
gösteren gazlar için
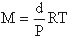
eşitliğinden mol tartısının elde edilebileceğini söylemiştik (1). İdeal bir gaz için,
gazın yoğunluğu basınç ile orantılıdır ve herhangi bir basınç için 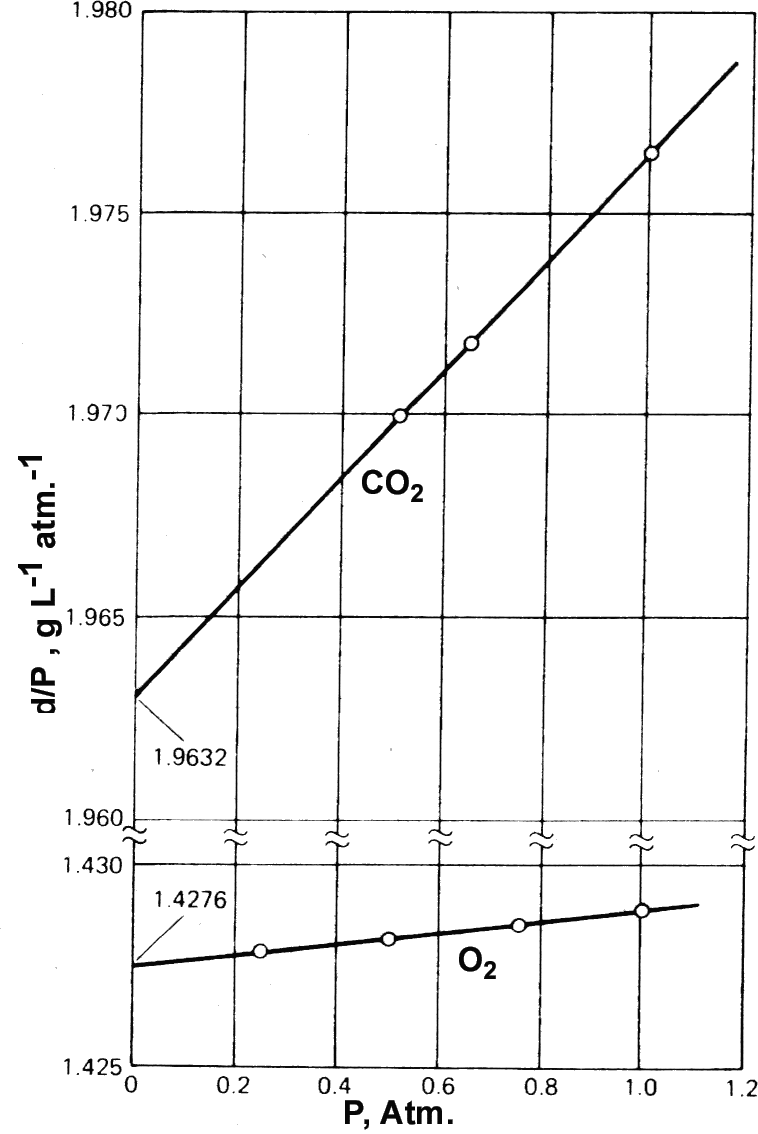 d/P oranı sabittir.
gerçek gazlar için ise yandaki şekilde de görüldüğü gibi d/P
basıncın fonksiyonudur. Buradaki değişim doğrusaldır ve
d/P oranı sabittir.
gerçek gazlar için ise yandaki şekilde de görüldüğü gibi d/P
basıncın fonksiyonudur. Buradaki değişim doğrusaldır ve
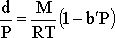
eşitliği ile verilir. Buradaki b' gazın doğası ve
sıcaklığına bağlı sabit bir sayıdır. Gazın mol kütlesi basınç sıfıra
giderken d/P oranından yararlanılarak hesaplanabilir. Gazların PVT
davranışlarını veya maddenin diğer hallerini tanımlamak için yazılan eşitlikler Hal
Eşitlikleri olarak adlandırılır. PV=nRT veya PV=RT ideal bir gaz için hal
eşitliğidir. 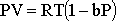 eşitliği, gerçek gazlar için
kullanılan hal eşitliklerinden biridir. Benzer şekilde çeşitli eşitlikler
kullanılır. Gerçek gazların farklı basınç-sıcaklık aralıklarındaki
davranışlarını incelemek için farklı hal eşitliklerinin kullanılmasını
gerekebilir.
eşitliği, gerçek gazlar için
kullanılan hal eşitliklerinden biridir. Benzer şekilde çeşitli eşitlikler
kullanılır. Gerçek gazların farklı basınç-sıcaklık aralıklarındaki
davranışlarını incelemek için farklı hal eşitliklerinin kullanılmasını
gerekebilir.
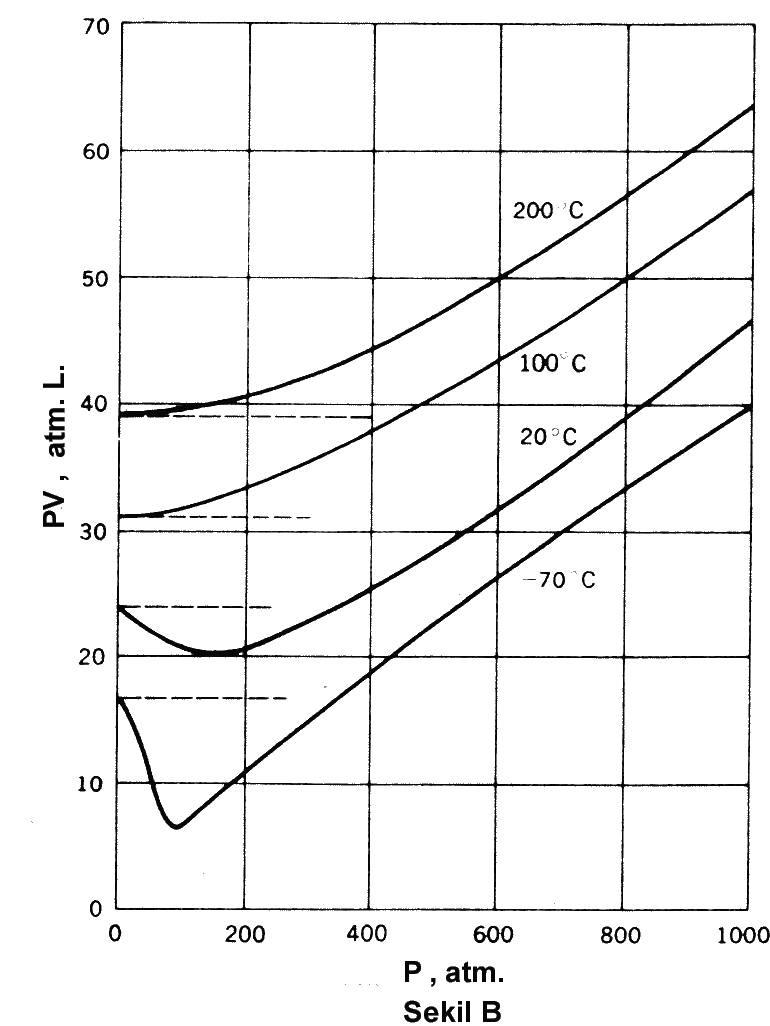
0 oC de 1 mol gaz için, yüksek basınçlarda PV nin basınca
bağımlılığı alttaki Şekil A da verilmiştir. Şekil B de ise, dört farklı
sıcaklıkta metan için PV nin basınca bağımlılığı verilmiştir.
İdeallikten sapma, genellikle basınca karşı PV/RT değişiminden
hareketle gösterilir. İdeal davranan gazlar için bu oran sabit ve 1 dir.
PV/RT nin değeri genel olarak gazların idallikten sapmalarının bir
ölçüsü olarak alınır ve bu oran sıkıştırılabilirlik föktörü ,Z,
olarak adlandırılır. İdeal davranış Z nin tüm sıcaklık ve basınçlarda
değerinin 1 olmasını gerektirir.
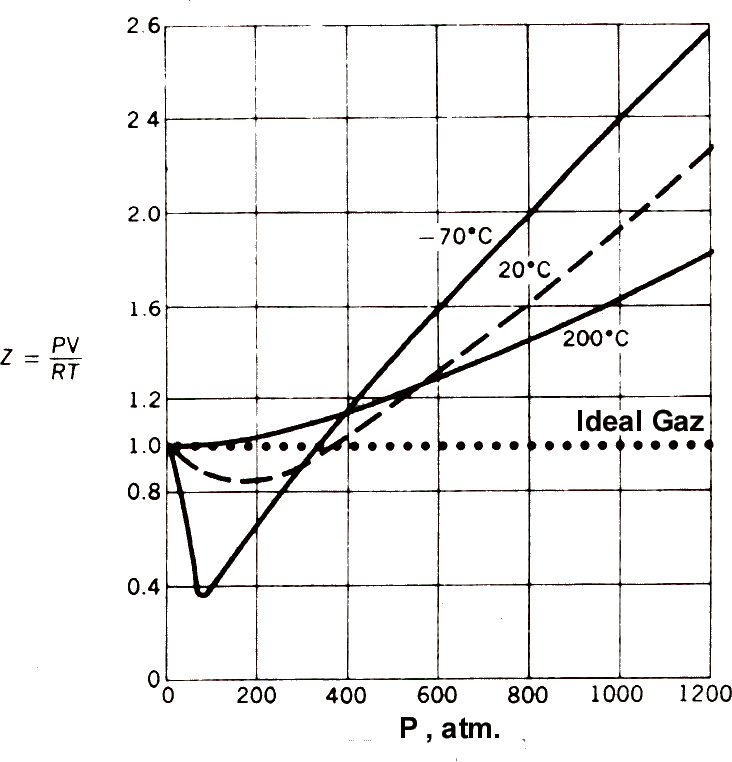 Yandaki şekilde metan için
farklı sıcaklıklarda Z değerleri gösterilmiştir. Bu şekildeki gaz
davranışlarını çözümleyebilmek için;
Yandaki şekilde metan için
farklı sıcaklıklarda Z değerleri gösterilmiştir. Bu şekildeki gaz
davranışlarını çözümleyebilmek için;
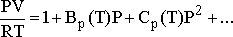
n mol için,
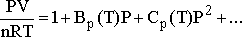 (1)
(1)
şeklindeki virial eşitlik olarak adlandırılan eşitlikler
kullanılır. BP(T) ve CP(T) katsayıları ise virial katsayılar
olarak adlandırılır. katsayılardaki P terimleri katsayıların basınca bağlı
olduğunu gösterir. Parantezler içindeki T ler ise sıcaklığa bağımlılığı
gösteririler. Başka bir viral katsayılar eşitliği
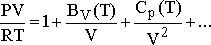 (2)
(2)
olup, BV(T) ve CV(T)
katsayıları PVT değerlerinin ölçülmesiyle elde edilirler. Aşağıdaki tabloda metan
için viral katsayılar verilmiştir. Hacime ve basınca bağlı virial katsayılar
arasında BP=BV/RT şeklinde basit bir ilişki
vardır.
Yukarıdaki şekillerde de görüldüğü gibi düşük sıcaklıklarda
grafiğin eğimi negatif iken yüksek sıcaklıklarda pozitiftir. Eşitlik 1 ve 2 deki B
katsayılarının değeri bu eğime eşittir.
Şekillerdeki izotermlerden de görüldüğü gibi basınç sıfıra
giderken d(PV)/dp değeri de sıfıra ulaşır ve PV
değeri sabit bir değere sahiptir. B=0 şartını sağlayan sıcaklık Boyle
Sıcaklığı olarak adlandırılır.
Tablo 1 : Yaklaşık 400 atmosfer basınca kadar metan için Virial Katsayılar
PV/RT = 1 + BV/V + CV/V2 + DV/V3 |
|
t
oC |
BV
L mol-1 |
CV
L2 mol-2 |
DV
L3 mol-3 |
|
0
25
50
100
150
200
250
300
350 |
-0.05335
-0.04282
-0.03423
-0.02100
-0.01140
-0.00416
0.00149
0.00598
0.00966 |
0.002393
0.002102
0.002150
0.001834
0.001640
0.001514
0.001420
0.001360
0.001330 |
26x10-5
15
1.3
2.7
3.5
4.3
5.2
5.7
5.9 |
|
PV/RT = 1 + BPP + CPP2 + DPP3 |
|
t
oC |
BP
atm.-1 |
CP
atm.-2 |
DP
atm.L-3 |
|
0
25
50
100
150
200
250
300
350 |
-0.002380
-0.001750
-0.001291
-0.000686
-0.000328
-0.000107
0.000035
0.000127
0.000188 |
-0.900x10-6
+0.450x10-6
1.390
1.486
1.252
0.993
0.769
0.599
0.473 |
30x10-9
18
8.2
4.3
2.1
1.03
0.58
0.32
0.17 |
|
KAYNAKLAR
Barrow Gordon M., Physical Chemistry, Fourth Edition, McGraw-Hill
Internationl Book Company, 1979, ISBN 0-07-066170-7
 Düşük sayılabilecek basınçlarda
birkaç gaz için 0 oC de 1 mol gaz için basıncın bir fonksiyonu olarak PV
değerleri hassas belirlenerek yandaki grafikte verilmiştir. İdeal davranış
gösteren gazlar için PV değişimi basınçtan bağımsız olmalıdır. Grafiktende
görüldüğü gibi Ne, O2 ve CO2 gazlarının hiçbiri için
P ye karşı PV değişimi sabit değildir. Bu davranışı irdeleyecek olursak, bu
bizi PV=nRT eşitliği üzerinde bazı değişiklikler yapmamız gerektiği
gerçeğine götürür. 1 mol gaz bu davranışı tanımlamak için
Düşük sayılabilecek basınçlarda
birkaç gaz için 0 oC de 1 mol gaz için basıncın bir fonksiyonu olarak PV
değerleri hassas belirlenerek yandaki grafikte verilmiştir. İdeal davranış
gösteren gazlar için PV değişimi basınçtan bağımsız olmalıdır. Grafiktende
görüldüğü gibi Ne, O2 ve CO2 gazlarının hiçbiri için
P ye karşı PV değişimi sabit değildir. Bu davranışı irdeleyecek olursak, bu
bizi PV=nRT eşitliği üzerinde bazı değişiklikler yapmamız gerektiği
gerçeğine götürür. 1 mol gaz bu davranışı tanımlamak için  d/P oranı sabittir.
gerçek gazlar için ise yandaki şekilde de görüldüğü gibi d/P
basıncın fonksiyonudur. Buradaki değişim doğrusaldır ve
d/P oranı sabittir.
gerçek gazlar için ise yandaki şekilde de görüldüğü gibi d/P
basıncın fonksiyonudur. Buradaki değişim doğrusaldır ve 

 Yandaki şekilde metan için
farklı sıcaklıklarda Z değerleri gösterilmiştir. Bu şekildeki gaz
davranışlarını çözümleyebilmek için;
Yandaki şekilde metan için
farklı sıcaklıklarda Z değerleri gösterilmiştir. Bu şekildeki gaz
davranışlarını çözümleyebilmek için;