Bu özellikleri tanımlayabilmek için iki değişken yeterli olabilir. Örneğin 1 mol maddeyi dikkate alacak olursak, maddeye ilişkin hacim , iç enerji, entalpi gibi fonksiyonlar ile ilgileniriz. Sık olarak Bu özelliklerin sıcaklık ve basınca bağlı olduğunu düşünebiliriz. Bu bağımlılığı,
U = f(T, P)
şeklinde gösterebiliriz.
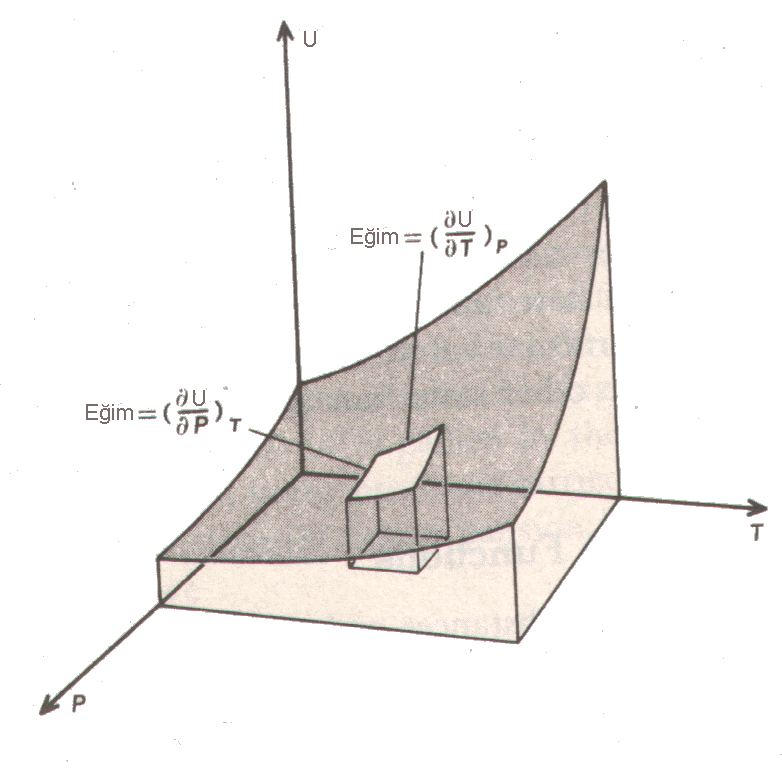 Bu ilişki grafiksel olarak yandaki gibi gösterilebilir. U nin P ve T bağımlılığı ayrı ayrı
kısmi türevleri şeklinde
Bu ilişki grafiksel olarak yandaki gibi gösterilebilir. U nin P ve T bağımlılığı ayrı ayrı
kısmi türevleri şeklinde  ve
ve 
olarak gösterilebilir. İç enerji için toplam difransiyel

yazılabilir. İç enerji değişimi genellikle sıcaklık ve hacmin bir fonksiyonu olarak,

Şeklinde, Entalpi ise sıcaklık ve basıncın fonksiyonu

olarak ele alınır.
Kısmi türevleri içeren eşitlikler için genelde dört yardımcı noktaya dikkat etmek gerekir.
1. (
 U/
U/ V)T ve
(
V)T ve
( U/
U/ T)V kısmi türevleri T ve V
nin fonksiyonu olduklarından
T)V kısmi türevleri T ve V
nin fonksiyonu olduklarından 
yazılabilir.
2. Süreçler için fonksiyon sabit kalıyorsa, örneğin dU=0 ise;
 = 0
= 0yazabiliriz. Bu eşitlik kısmi türev kurallarına göre yeniden düzenlenirse;
 veya
veya 
yazılabilir.
3. Eğer bir türev toplam difransiyellerden oluşuyorsa, örneğin ;

eşitliği için dT veya dV ye bölünerek
 veya
veya 
eşitlikleri yazılabilir.
4. Aynı değişkenlerin sabit tutulduğu türevler ve kısmi türevler, kesirler halinde kullanılabilir. Örneğin dV/dP için;
(dV/dP) = (dV/dU)(dU/dP)
Benzer şekildeki kısmi türev işlemi için;
(
 V/
V/ P)T = (
P)T = ( V/
V/ U)T(
U)T( U/
U/ P)T
P)Tyazılabilir.
Bunlara benzer eşitlikler ideal gazların davranışlarını açıklamak için geelecekbölümlerde kullanılacaktır.