İdeal Gazların Adyabatik Genleşmesi
Yalıtılmış veya izole edilmiş bir sistemde ısı kaybı veya kazancı yoksa adyabatik olarak adlandırılır.
Adyabatik süreçler pekçok termodinamik kavramı geliştirmek için önemlidir. İdeal bir gazın adyabatik ve tersinir bir süreçte PVT
davranışı incelenmeğe değerdir. Elde edilen sonuçlar, izotermal genişlemedeki PVT davranışı ile karşılaştırılırsa
iki süreç arasındaki farklılıklar kolayca görülebilir. İzotermal genişlemede T nin sabit ve bu nedenle PV nin sabit olduğu gözden kaçırılmamalıdır.
n mol ideal gaz için;
(dU/dT) = nCv veya dU = nCvdT
yazabiliriz. Tersinir genleşmenin olduğu bir süreç için ortaya çıkacak işi
W = - PdV = - (nRT/V)dV
eşitliği ile daha önce göstermiştik (1). Adyabatik bir süreç için
q = 0 olduğu için, termodinamiğin birinci kanununa göre
dU = W veya
 veya
veya 
yazılabilir. T1 sıcaklığındaki V1 hacmine sahip bir gazın T2
sıcaklığında V2 hacmindeki bir duruma ulaşması sırasında Cv değerinin sabit kaldığını varsayarsak;
 veya
veya 
eşitliklerini yazabiliriz.
Eşitliği yeniden düzenlersek;

eşitliği elde edilebilir. Elde edilen eşitliği daha kullanışlı hale getirmek için T1 ve T2 sıcaklıkları için
T = PV/nR ve Cp = Cv + R düzenlemesini yapalım. Böylece;

eşitliğini elde ederiz.
iki ısı kapasitesinin oranı genellikle, g = Cp/Cv olarak ifade edilir. Böylece;
 veya PVg = Sabit
veya PVg = Sabit
yazabiliriz.
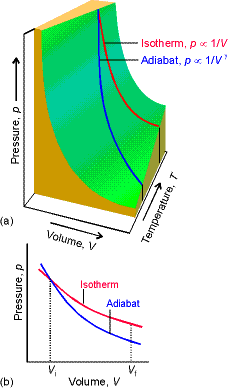 Tersinir ve adyabatik bir süreçte V ye karşı P nin çizimi yandaki çizimde gösterilmiştir. Gaz izotermal olarak genleştiğinde
gaz iş yapmak için ısı absorbe eder. Tersinir adyabatik bir genleşme için ise gaz kendi termal enerjisini kullanmak zorunda kalır.
Sonuç olarak sıcaklık düşer ve basınç değişimi izotermal genişlemeye karşı gelen basınç değişiminden daha fazla olur.
(Örnek 1, 2)
Tersinir ve adyabatik bir süreçte V ye karşı P nin çizimi yandaki çizimde gösterilmiştir. Gaz izotermal olarak genleştiğinde
gaz iş yapmak için ısı absorbe eder. Tersinir adyabatik bir genleşme için ise gaz kendi termal enerjisini kullanmak zorunda kalır.
Sonuç olarak sıcaklık düşer ve basınç değişimi izotermal genişlemeye karşı gelen basınç değişiminden daha fazla olur.
(Örnek 1, 2)
E l e k t r o n i k K a y n a k l a r
Joule's Law
Joule's Mechanical Equivalent of Heat Apparatus
Joule's Equivalent
James Prescott Joule (1818 - 1889)
 veya
veya 
 veya
veya 


 veya PVg = Sabit
veya PVg = Sabit Tersinir ve adyabatik bir süreçte V ye karşı P nin çizimi yandaki çizimde gösterilmiştir. Gaz izotermal olarak genleştiğinde
gaz iş yapmak için ısı absorbe eder. Tersinir adyabatik bir genleşme için ise gaz kendi termal enerjisini kullanmak zorunda kalır.
Sonuç olarak sıcaklık düşer ve basınç değişimi izotermal genişlemeye karşı gelen basınç değişiminden daha fazla olur.
(Örnek
Tersinir ve adyabatik bir süreçte V ye karşı P nin çizimi yandaki çizimde gösterilmiştir. Gaz izotermal olarak genleştiğinde
gaz iş yapmak için ısı absorbe eder. Tersinir adyabatik bir genleşme için ise gaz kendi termal enerjisini kullanmak zorunda kalır.
Sonuç olarak sıcaklık düşer ve basınç değişimi izotermal genişlemeye karşı gelen basınç değişiminden daha fazla olur.
(Örnek